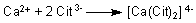
Isolierung von Citronensäure aus Zitronen
Experimente:
Versuch: Herstellung von Calciumcitrat
Versuch: Darstellung von Citronensäure mit einem Kationenaustauscher
Versuch: Kristallisation von Citronensäure
Bis zur Mitte des 20. Jahrhunderts wurde Citronensäure fast ausschließlich aus unreifen Zitronen gewonnen. Sie wurde erstmals 1784 von Carl Wilhelm Scheele isoliert. Seinen Bericht dazu kannst du selbst auf einer eigenen Webseite nachlesen.
Isolierung nach C. W. Scheele
Zunächst werden die Früchte ausgepresst. Der Zitronensaft wird filtriert, alkalisch eingestellt und
mit Calciumchlorid versetzt. Dabei entsteht in der Kälte ein wasserlöslicher
Komplex:
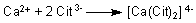
Beim Erhitzen mit überschüssigen Calcium-Ionen bildet sich Tricalciumcitrat, welches in Wasser schwer löslich ist und ausfällt (-> Versuch):
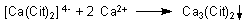
Das Calciumcitrat wird abgetrennt, gewaschen und mit verdünnter Schwefelsäure zu Citronensäure und Gips umgesetzt:
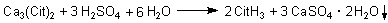
Das Calciumsulfat fällt aus, während die in Wasser sehr gut lösliche Citronensäure in Lösung bleibt. Nachdem der aus Gips bestehende Bodensatz abgetrennt wurde, lässt man nun die Citronensäure auskristallisieren. Dieser Schritt erfordert sehr viel Geschick und Sorgfalt. Insbesondere ist darauf zu achten, dass kein Überschuss an Schwefelsäure zurückbleibt, da diese sonst beim Eintrocknen der Lösung konzentriert würde, woraufhin die Citronensäure durch Wasserabspaltung zu Aconitsäure umgesetzt würde. In der Schule gelingt er deshalb in der Regel nicht.
Isolierung mit einem Ionenaustauscher
Hier bietet sich die Verwendung eines sauren Kationenaustauschers
anstelle der Schwefelsäure an (-> Versuch) [13]. Auf diese Weise wird das Calciumcitrat
quantitativ zu Citronensäure umgesetzt, ohne dass als Nebenprodukt Gips
entsteht, der bei der Isolierung der Citronensäure stört. Darüber hinaus lässt
sich der Kationenaustauscher einfach mit Salzsäure regenerieren. Das dabei
entstehende Calciumchlorid ist umweltneutral und kann zum Beispiel im Winter
als Streusalz verwendet werden.
Die auf diese Weise hergestellte Citronensäure wurde von uns chromatographisch (mittels
HPLC) untersucht. Dabei stellte sich heraus, dass die Probe einen
Citronensäuregehalt von 96 % hatte, also recht rein war.
Citronensäure ist hitzeempfindlich
Die Citronensäure kristallisiert schlecht, da sie zur Bildung stark übersättigter
Lösungen neigt. Man erhält im Allgemeinen eine sirupartige Mischung. Man darf dann
aber keinesfalls versuchen, den Sirup durch Erwärmen zu entwässern. Ab 60 °C
beginnt nämlich die Zersetzung der Säure, erkennbar an der Gelbverfärbung der
Mischung. Besser ist es, abzuwarten und das Wasser in einer offenen Schale langsam
abdunsten zu lassen (-> Versuch).
Weitere Texte zum Thema „Zitrone“