 |
[Fe3(OH)2(CH3COO)6]+CH3COO- |
| (Foto: Daggi) |
Nachweisreaktionen der Essigsäure sowie der Acetate
Experimente
Versuch: Komplexbildung mit Eisen(III)-chlorid
Versuch: Nachweis von Acetaten mit Schwefelsäure
Versuch: Nachweis von Acetaten mit Kaliumhydrogensulfat
Versuch: Nachweis von Acetaten durch Esterbildung
Wenn wir die Reaktionen der Essigsäure kennen gelernt haben, können wir uns auch Nachweisreaktionen
überlegen. Zum sicheren Nachweis sollten alle drei Versuche positiv verlaufen!
1. Essiggeruch
Am ehesten erkennt man Essigsäure an ihrem Geruch. Als schwache und dazu noch flüchtige Säure kann
man sie mit Schwefelsäure bzw. ihren sehr aggressiven Hydrogensalzen "austreiben".
- Halbkonzentrierte Schwefelsäurelösung zur Prüfsubstanz oder Flüssigkeit zutropfen (-> Versuch).
2 NaCH3COO + H2SO4 ———> Na2SO4 + 2 CH3COOH
- Festsubstanz mit KHSO4 zerreiben (-> Versuch).
NaCH3COO + KHSO4 ———> KNaSO4 + CH3COOH
2. Farbreaktion
Bekannt ist die Komplexierung mit Fe3+-Salzen (-> Versuch).
Hierbei bildet sich eine tiefrote Komplexverbindung, der man
die folgende Zusammensetzung zuschreibt.
 |
[Fe3(OH)2(CH3COO)6]+CH3COO- |
| (Foto: Daggi) |
Wichtig ist, dass nur die Acetate eine tiefrote Färbung geben. Mit der Säure bildet sich nur ein helles
Rotbraun aus.
Jedoch bilden auch andere niedermolekulare Säuren wie die Ameisensäure und die Propionsäure sowie die Aminoessigsäure ähnlich gefärbte Komplexe.
3. Esterbildung
Der Essigsäureethylester hat einen so typischen Geruch nach UHU®, dass
man seine Entstehung als Nachweis auf Essigsäure oder Acetate nutzen kann (-> Versuch).
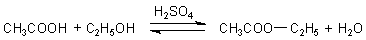
Wie wird Essigsäure heute nachgewiesen?
Zur Trennung von Säuregemischen und zur quantitativen Bestimmung der Essigsäure bedient man sich
verschiedener technischer Methoden. Beispiele sind:
| 1. | Veresterung der Essigsäure (und anderer Säuren) mit Diazomethan und Trennung der Methylester mit dem Gaschromatographen |
| 2. | Trennung der Säuren mit der Hochleistungsform der Flüssigchromatographie, der HPLC |
| 3. | Ionenchromatographie |
| 4. | Enzymatische Methoden |
Weitere Texte zum Thema „Essig“