 |
 |
 |
 |
| Anfragen wegen Facharbeiten
Aus dem E-Mail-Korb von Professor Blume |
796
F: Ich besuche in der Schweiz die letzte Klasse des Gymnasiums. Im Rahmen meiner Maturaarbeit
beschäftige ich mich mit Vitamin C. Auf der Suche nach Anregungen bin ich dann auf Ihre Homepage gestossen. Zuerst einmal ein grosses
Kompliment für die spannenden Experimente und Erklärungen! Die Seite hat mir geholfen, den Themenbereich meiner Arbeit einzugrenzen.
Ich habe unterschiedliche Experimente mit Vitamin C durchgeführt, um die Reaktionsvielfalt dieses Stoffes aufzuzeigen. Alle diese
Experimente haben wunderbar geklappt, jetzt muss ich mich aber an den theoretischen Teil meiner Arbeit machen, welcher mir einige
Schwierigkeit bereitet. Mir fehlen nämlich die Textquellen zu den einzelnen Reaktionsvorgängen und zu Vitamin C allgemein. Zwar
haben meine Chemiekenntnisse ausgereicht, um alle diese Experimente durchzuführen, doch möchte ich meine Maturaarbeit auch mit
Quellen absichern. Auch bei der Erklärung der Vorgänge reicht es dann nicht, wenn ich schreibe, es ist jetzt halt einfach so…
Ich wäre Ihnen deshalb sehr verbunden, wenn Sie mir vielleicht einige Textquellen angeben könnten, die sich mit Vitamin C oder
den Reaktionsmechanismen beschäftigen. Meine Chemielehrerin konnte mir nämlich auf diesem Gebiet nur wenig weiterhelfen.
Hier nun kurz zusammengefasst der Inhalt meiner Arbeit: Als Endprodukt entsteht ein Film über Vitamin C, der auch als Lernmaterial für die Schule einsetzbar sein soll. Dieser setzt jedoch ein gewisses chemisches Wissen voraus. Ich beschäftige mich jedoch nicht mit den Wirkungen von Vitamin C im menschlichen Körper, sondern beschränke mich auf Vitamin C als chemischen Stoff mit all seinen Reaktionen. Im Bereich der Redoxreaktionen habe ich Reaktionen mit Kaliumpermanganat, Kupfersulfat und DCPIP durchgeführt. Bei den Säure-Base-Reaktionen verwendete ich Magnesium und Calciumcarbonat als Reaktionspartner. Ebenfalls habe ich unterschiedliche Titrationen durchgeführt. Zusätzlich habe ich eine Batterie mit Vitamin C und Tetrachlorgoldsäure hergestellt und die Silberspiegel-Reaktion mit Vitamin C anstelle von Glucose durchgeführt. Und schliesslich habe ich auch eine Clock-Reaction mit Wasserstoffperoxid durchgeführt.
In meiner Arbeit muss ich nun einen Theorieteil über Vitamin C allgemein und alle vorkommenden Reaktionsarten verfassen. Es fehlen mir nämlich auch Unterlagen zu Redoxreaktion, Säure-Base-Reaktionen, Kinetik etc. allgemein. Alle diese Reaktionstypen haben wir auch in der Schule behandelt, doch möchte ich sie in meiner Arbeit ausführlicher behandeln. Alles, was ich bisher dazu gefunden habe, war entweder zu einfach oder einfach nur unverständlich.
Ich hoffe, dass ich Sie mit meiner Anfrage nicht überrollt habe… Es wäre für mich wirklich eine grosse Hilfe, wenn ich Anhaltspunkte hätte, wo ich noch zusätzliches Material und Theorie zu meiner Arbeit finden könnte.
A: Leider kann ich hinsichtlich der Literaturliste nicht helfen, denn zur AscH2 gibt es seit
ihrer Entdeckung eine Flut von Publikationen.
In unserer Webseitengruppe zur AscH2-Chemie haben wir eine kurze Literatur-Liste. Es ist heute aber auch in der „echten“ Wissenschaft üblich, Webseiten als Literatur anzugeben. Das sollten Sie auch tun.
Zu Ihrem Theorieteil und dieser Frage: “In meiner Arbeit muss ich nun einen Theorieteil über Vitamin C allgemein und alle vorkommenden Reaktionsarten erfassen. Es fehlen mir nämlich auch Unterlagen zu Redoxreaktion, Säure-Base-Reaktionen, Kinetik etc. allgemein.“
Da kann ich nur auf unsere Webseitengruppe zur AscH2 verweisen. Ich gehe davon aus, dass Sie diese kennen: In dieser Webseitengruppe wird zu den Redox- und Säure/Base-Reaktionen sowie zu den Radikalreaktionen und so weiter der Ascorbinsäure ausführlich berichtet.
797
F: Bei Recherchearbeiten bin ich auf Ihren Bildungsserver gestoßen und habe mir einige Artikel
angesehen. An ihrem E-Mailkorb habe ich bemerkt, dass man ihnen anscheinend auch fachliche Frage senden kann, die sie dann eventuell
beantworten. Ich hoffe die von mir gewählte Adresse r.blume@chemieunterricht.de ist die richtige für solche Fragen und sie finden Zeit
und Lust meine Fragen zu beantworten, gerne auch mit einem Verweis auf einen ihrer Artikel.
Nun zu meinen Fragen. Ich arbeite als Schüler eines Gymnasiums in der Q11 zurzeit an einer Facharbeit über Abflussreiniger.
Bei der Wirkung der Natronlauge auf Proteine von Haaren oder Essensresten wird immer wieder von der denaturierung durch die Lauge
gesprochen. Jedoch wird einmal behauptet die Denaturierung entstehe durch die Ladungsänderungen an den einzelnen Peptiden wodurch sich
die zwischenmolekularen Kräfte innerhalb des Proteins ändern und so die bisherige Sekundär- oder Tertiärstruktur verloren geht.
Andererseits wird oft angesprochen, beispielsweise in ihrem Artikel http://www.chemieunterricht.de/dc2/wsu-haush/ im Kapitel 4.1.1,
dass die Lauge die Proteine hydrolisiert und so in einzelne Aminosäuren gespalten werden.
Meine Fragen dazu: Welcher der beiden Vorgänge ist die Denaturierung? Und geschehen diese Vorgänge beide bei der Verwendung von
Abflussreinigern, also mit NaOH? Welcher ist maßgeblich für die Wirkung von Abflussreinigern?
Meine anderen Fragen beschäftigen sich mit der Komponente Hypochlorit, welche sich oft in flüssigen Abflussreinigern findet. Bei meiner Recherche fand ich heraus, dass dieser Stoff oft als Bleichmittel verwendet wird. Jedoch habe ich auch gelesen, dass er bei Abflussreinigern eine Rolle spielt. Und zwar soll er Haare (also Proteine) Zersetzten bzw. bei der Zersetzung helfen. Meine Frage: Wie oder inwiefern tut er das?
Ich freue mich auf ihre Antwort die hoffentlich mein Problem lösen wird. Und nicht nur weil ich ihr Vorwort zum e-mail Korb gelesen habe, kann ich nicht umhin mich schonmal im vorraus zu bedanken.
A: Es ist alles richtig. Zum einen verändert die pH-Wertänderung die elektrische Ladung und
damit die Außenstruktur der Proteine. Weiter können die kleinen Hydroxid-Ionen in das Gefüge der Keratinmoleküle eindringen und das
Haar aufquellen lassen, so dass es leichter für weitere Chemikalien angreifbar wird. Das ist aber noch keine Denaturierung. Dazu
ist eine bleibende chemische Veränderung nötig - wie im Folgenden gezeigt:
Die Lauge zerstört Bindungen im Protein, z. B. durch Hydrolyse von Peptidbindungen oder zur Abspaltung von Ammoniak (und so weiter)
aus den Seitenketten.
Analog wirkt auch Hypochlorit: Das setzt mit Wasser Sauerstoffatome frei, die stark oxidierend wirken und Proteinmoleküle oxidativ abbauen.
Zum Abflussreiniger haben wir eine Webseite.
798
F1: Mein Name ist (…) und ich besuche zurzeit die 12. Klasse des (…)-Gymnasiums in (…). Da wir in
diesem Schuljahr die Möglichkeit haben eine Facharbeit zu schreiben und einer meiner Leistungskurse das Fach Chemie ist, habe ich mich
für das Thema Tintenkiller entschieden. Bei der Suche nach Informationen bin ich auf Ihren Tipp des Monats gestoßen. Da mir dieser Artikel
sehr gut gefallen hat, wollte ich Sie bitten mir einige Ihrer verwendeten Materialien per E-Mail zukommen zu lassen. Über eine Antwort von
Ihnen würde ich mich sehr freuen.
A1: Welche Materialien meinen Sie?
F2: Erst einmal vielen Dank für die schnelle Antwort. Mit den Materialien meinte ich Quellen
oder Texte die sie verwendet haben um Ihren Tipp des Monats zu schreiben. Da es sehr schwer ist genügend geeignete und seriöse
Informationen über die Wirkungsweise eines Tintenkillers im Internet zu finden (viele der Texte basieren auf Ihrem) und unsere
Schulbibliothek auch nicht mehr auf dem neusten Stand ist, hatte ich gehofft, dass sie mir weiterhelfen könnten.
A2: Sind Ihnen meine Webseiten nicht seriös genug?
Es handelt sich bei den Inhalten meiner Tipp-Webseite um Standardwissen der Chemie. In diesem Zusammenhang nach Literaturhinweisen zu fragen, ist echt ungewöhnlich. Das wäre so, als wenn Sie einen F 15-Jetpiloten fragen, ob er Ihnen Literaturhinweise zur Erfindung des Fliegens geben könne.
Ein Hinweis: Mittlerweile ist es üblich, auch Webseiten als zitierfähige Literaturquelle zu nutzen.
799
F: Ich möchte mich zu allererst für Ihre Bemühungen bedanken, den Schülern das Fach Chemie
durch die facettentreiche Beiträge im Bildungsserver Chemie näher zu bringen. Es freut mich dabei sehr, dass Sie auch auf die einzelnen
E-mails der Schüler eingehen und ihnen bei Verständnisproblemen behilflich werden. Vor einigen Wochen haben Sie mich beispielsweise über
die "Keto-Enol-Tautomerie" der Ascorbinsäure aufgeklärt, welche (zu meiner Überraschung) ganz auf der Enolseite, liegt.
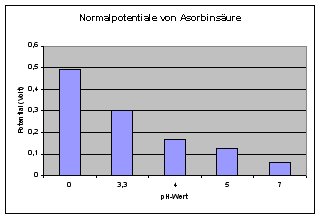
1) Auf Ihrer folgenden Seite http://www.chemieunterricht.de/dc2/asch2/a-t-rdph.htm ist das
Standardpotentialder Ascorbinsäure von E0= 0,06V bei pH 7 angegeben. Ich bin aber auch auf andere Literaturwerte für das Standard-potential
gestossen:
| E0 in V | pH |
| 0,490 | 0 |
| 0,200 | 3,3 |
| 0,166 | 4,0 |
| 0,172 | 5,0 |
| 0,06 | 7,0 |
(Quelle: PdN-Chemie Heft 7/57, Okt. 2008, "Vitamin C - Ein chemisches Chamäleon, S.18)
Welches ist der richtige Wert bzw. kann man das Standarpotential bei unterschiedlichen pH-Werten angeben?
Mir ist zwar die pH-Abhänigkeit des Redoxpotentials der AscH2 bekannt, aber braucht man für die Berechnung der verschiedenen
Redoxpotentiale durch die Nernst-Gleichung keinen "Fixwert" für E0?
2) Meine zweite Frage bezieht sich auf einen Versuch über die Ascorbinsäure. Der Versuch ist folgender:
Zunächst habe ich einige Tropfen Ascorbinsäure-Lösung in eine Permanganat-lösung MnO4- gegeben, wobei letztere entfärbt wurde.
Als nächstes habe ich denselben Versuch erneut durchgeführt, diesmal habe ich aber die Ascorbinsäure-Lösung zuvor aufgekocht und
danach in die zweite Permangant-Lösung hinzugegeben habe. In dem Fall entstand statt Mn2+ Braunstein, welches am braunen Niederschlag
deutlich war. Die erster Versuch beruht auf dem Redoxsystem zwischen Ascorbinsäure und Permanganat im sauren Milieu, wobei Mn2+ und
Dehydroascorbinsäure entsteht.
Jedoch kann ich mir im zweiten Versuchsablauf nicht ableiten, warum plötzlich Braunstein ausfällt. Eigentlich sollte doch die
violette Färbung erhalten bleiben, da Dehydroascorbinsäure bereits bei der Reaktion von AscH2 mit Luftsauerstoff (durch das Aufkochen)
entsteht :
AscH2 -> DAS + 2H+ + 2e
O2 + 2H+ + 2e-> H2O2 + 2 H2O
Ich hoffe Sie können mir auf die Sprünge helfen, da nur Sie mir als geeigneter Ansprechpartner in den Sinn kamen.
A: Die Standard-Potentiale E0 lassen sich für jeden pH-Wert angeben. Man kann
dazu z. B. vom E0-Wert bei pH-Wert 0 (+ 0,490 Volt) ausgehen. Wichtig ist, dass der Konzentrations-Quotient Asch2/Ascox
stets gleich 1 ist. Die Abweichungen von diesem E0 sind die Werte entsprechend etwa denen einer Standardwasserstoffelektrode
bei den entsprechenden pH-Werten. Allerdings sind die Angaben in der Literatur ziemlich unterschiedlich, was am nicht genau definierbaren
Redoxverhalten der AscH2 liegt. Ihr Wert für pH 5 enthält wohl einen Zahlendreher, also 0,172 statt 0,127.
Schauen Sie übrigens mal in Tabellen für Standardpotentiale: Man findet diese für ein Redoxsystem im Allgemeinen für pH 0 und pH 14 angegeben. Biochemische Tabellen dagegen beziehen sich auf pH 7.
Zum Kaliumpermanganat. Ich vermute, dass Ihre Lösungen beim zweiten Einsatz von KMnO4 nicht mehr sauer genug waren. Im Neutralen bzw. Alkalischen fällt Braunstein aus. Denken Sie daran, dass bei den Redoxreaktionen mit Permanganat Protonen verbraucht werden und dass außerdem KMnO4-Lösungen alkalisch sind.
Wieso bei Ihrer Reaktion mit Luftsauerstoff H2O2 entstehen soll, verstehe ich nicht.
800
F: Seit einigen Jahren besuche ich regelmäßig Ihren "Bildungserver für Chemie" und konnte mir dadurch
sehr viele Fragen beantworten, die über das vom Lehrplan festgelegte Wissen, einer Chemie-Grundkursschülerin hinausging.
Momentan arbeite ich an meiner Facharbeit in Chemie zum Thema: „Alkohol eine Säure oder Base?“ Genau zu dieser Fragestellung habe ich bereits einige Informationen von Ihrer Homepage sammeln können. Durch eigene, erste Versuche mit Methanol kam ich folgerichtig zu dem selben Ergebnis, das auf Ihrer Seite angegeben wurde: Alkohol ist eher eine Base, als eine Säure. Ich habe beispielsweise destilliertes Wasser in Methanol gegeben und einen PH-Wert von 7,39 messen können. Für mich stellt sich nun die Frage, wie ich experimentell nachweisen kann, dass es sich bei Alkohol, bzw. Methanol um einen Ampholyten handelt? Des weiteren habe ich zu diesem Thema im Internet die verschiedensten Stellungnahmen lesen können, es wird teilweise damit argumentiert, dass man durch den pks-Wert Methanols darauf schließen kann, ob Methanol eher als Base oder eher als Säure an einer Reaktion teilnimmt. Kann man dies so pauschal sagen bzw. ist dies eine hinreichende Erklärung dafür, dass Methanol tatsächlich amphoter ist?
A: Wir haben im Kollegenkreis des Öfteren über diese Frage diskutiert - völlig ergebnisoffen.
Versuchen Sie also nicht, in Ihrer Facharbeit Universitätsprofessoren zu übertreffen…
Sie bewegen sich auf einem sehr schwierigen Gebiet der praktischen Chemie, das Sie mit schulischen Mitteln wohl kaum erschließen können. Pauschal kann man nicht von vornherein definieren, ob eine Substanz Base oder Säure ist. Das ist nämlich eine Frage des Reaktionsmilieus, also der beteiligten Gegensäuren/-basen. Der pKs-Wert muss auch milieuspezifisch (d. h. für verschiedene Lösemittelsysteme) definiert werden. Dazu muss man tief in die Brönsted-Säure/Base-Theorie einsteigen, die letztlich ja auch für nichtwässrige Lösemittel definiert wurde. (Methanol/Wasser-Mischungen zählen dazu.)
Hinzu kommt noch die Redoxdiskussion, z. B. bei der Reaktion von Alkoholen mit Natriummetall. Das alles ist Gegenstand meiner Webseite.