 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1536
F: Meine Frau und ich machen eine Totaldiät. Wir essen seit vier Tagen nichts mehr und trinken
nur destilliertes Wasser. Jetzt haben wir festgestellt, dass wir einen starken Körpergeruch entwickeln. Waschen hilft nichts. Woran
liegt das?
A: Bei dieser Art von Diät bekommt Ihr Körper keine Kohlenhydrate mehr. Vom Stoffwechsel her
ist er aber auf die Zufuhr von vor allem Glucose angewiesen. Glucose ist nämlich unverzichtbares Substrat zur Energiegewinnung in
Nervenzellen und roten Blutkörperchen (Erythrozyten). Außerdem reguliert er in manchen Organen den Citratzyklus. Hinzu kommt, dass
aus Glucose auch Glycerin(-phosphat) für die Fettsynthese hergestellt wird. Fette wirken nicht nur „Pölsterchen füllend“, sondern
sind unverzichtbare Bestandteile von z. B. Biomembranen der Zellen.
Deshalb schaltet der Organismus bei Kohlenhydrat-freier Ernährung auf „Gluconeogenese“ um. Dabei baut er unter anderem Proteine ab und synthetisiert aus bestimmten Aminosäuren über Lactat Kohlenhydrate. Dabei werden geruchsintensive Substanzen freigesetzt, zu denen Schwefelverbindungen sowie einige zyklische stickstoffhaltige Verbindungen („Heterozyklen“ wie Indole) gehören. Diese sind in Ihrer Atemluft sowie in den Hautausscheidungen enthalten und sorgen trotz Sauberkeit für intensiven Körpergeruch. Solche Abbaureaktionen der Proteine machen ansonsten Bakterien im Darm, wobei dann der typische Fäkaliengeruch entsteht.
Übrigens halte ich von Ihrer Diät gar nichts. Und dass Sie dazu noch destilliertes Wasser trinken, dürfte auch nicht gesund sein. Sie werden sicherlich bald Anzeichen von Mineralstoffmangel entwickeln.
1537
F: Ich bitte Sie darum, mir zu folgenden Nachweisen die entstehenden Stoffe mitzuteilen und wenn
möglich auch die Reaktionsgleichungen.
Leider konnte ich es alleine nicht herausfinden, deshalb wende ich mich nun an Sie:
Gehaltsbestimmung von Ammoniumchlorid:
1,000g Substanz wird in 20 ml Wasser gelöst. 1 bis 2 min nach Zusatz einer Mischung von 5 ml Formaldehyd-Lösung, die zuvor gegen
Phenolphthalein- Lösung neutralisiert wurde, und 20 ml Wasser wird die Lösung langsam mit Natriumhydroxid- Lösung (1 mol/ l) unter
Zusatz von 0,2 ml Phenolphthalein-Lösung titriert.
A: Es handelt sich um eine typische indirekte Bestimmungsmethode.
Ammonium-Ionen stehen mit in Wasser gelösten Ammoniakmolekülen im chemischen Gleichgewicht.
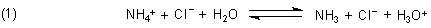
Gibt man Formaldehyd hinzu, so reagiert Ammoniak zu Aldehydammoniak und wird so dem Gleichgewicht (1) entzogen.
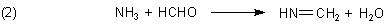
Man kann auch sagen, dass das Ammoniakmolekül durch Bildung dieser Schiffschen Base maskiert wird und auf diese Weise den üblichen Reaktionen entzogen ist (Gleichung (2)).
In der Lösung (1) bleibt HCl zurück, die wie bekannt mit Natronlauge gegen Phenolphthalein titriert wird.
Noch ein Hinweis: Formaldehyd muss zuvor prophylaktisch neutralisiert werden, da er durch Oxidation Ameisensäure gebildet haben könnte.
1538
F: Können Sie mir bei den Gleichungen für Gehaltsbestimmung von Kaliumpermanganat helfen?
0,300 g Substanz werden in Wasser zu 100,0 ml gelöst. Zu 20,0 ml Lösung werden 20 ml Wasser, 1 g Kaliumiodid und 10 ml verdünnte Salzsäure hinzugefügt. Das abgeschiedene Iod wird in Gegenwart von 1 ml Stärke-Lösung mit Natriumthiosulfat-Lösung (0,1 mol/ l) titriert.
A: Es handelt sich hierbei um einen gekoppelten Test, der aus zwei Schritten besteht.
1. Iodid reduziert Kaliumpermanganat.
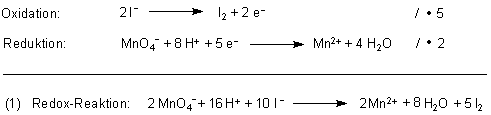
Das entstandene Iod reagiert mit restlichem Iodid erst zu Iod-Iodid-Komplexen und dann mit Stärke zu dem bekannten blauen Iod/Stärke-Komplex.
2. Aus der Menge an freigesetztem Iod sollten wir auf die Permanganat-Konzentration schließen können.
Um die Konzentration des Iods zu bestimmen, titriert man es mit Thiosulfatlösung, deren Konzentration bekannt ist. Dabei wird das Iod reduziert.
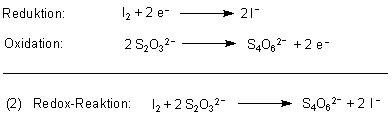
Die Reaktion (2) ist beendet, wenn die blaue Färbung wieder verschwunden ist.
Auswertung der Titration:
1 Vorausberechnung der zu erwartenden Ergebnisse:
Solche Überschlagsrechnungen sind immer hilfreich!
Molmasse KMnO4 158,04 g/mol.
In 0,3 g sind 0,3 g / 158,04 g/mol = 0,001898 mol KMnO4 enthalten.
2 / 5 mol KMnO4 entsprechen 1 mol Iod (siehe Reaktionsgleichung (1)). Es werden also 0,001898 mol • 5 / 2 = 0,004745 mol Iod gebildet.
1 mol Iod entspricht 2 mol Thiosulfat (siehe Reaktionsgleichung (2)). In einem Liter Thiosulfatlösung (c = 0,1 mol/l) sind 0,1 mol vorhanden.
0,05 mol Iod entsprechen folglich 1 Liter = 1000 ml einer 0,1-molaren Thiosulfat-Lösung. Nun berechnen wir, wie viel Thiosulfatlösung man benötigt, um 0,004745 mol Iod zu titrieren.
0,004745 / 0,005 = x ml / 1000 ml
= 94,9 ml Thiosulfatlösung sind als Zugabe zu erwarten
2 Rechnung nach vollzogener Titration
Titrationsverbrauch an Thiosulfatlösung (c = 0,1 mol/l): 94,9 ml.
x mol / 94,9 ml = 0,1 mol / 1000 ml
x = 0,00949 mol Thiosulfat
2 mol Thiosulfat entsprechen 1 mol Iod (siehe Reaktionsgleichung (2)). Die Iodmenge ist folglich 0,00949 / 2 = 0,004745 mol.
1 mol Iod entsteht bei der Reaktion von 2 / 5 mol KMnO4 (siehe Reaktionsgleichung (1)).
0,004745 mol Iod reagieren dann mit 0,004745 • 2 / 5 = 0,001898 mol KMnO4.
Das Multiplizieren mit der Molmasse von KMnO4 ergibt die Einwaage der Vorlage:
0,001898 mol • 158,04 g/mol = 0,300 g KMnO4-Vorlage.
1539
F: Ich versuche einer Freundin zu helfen, die PTA lernt. Sie hat das als Hausaufgabe und weiß nicht
woher sie es bekommen soll. Leider war ich auch mit meinem Latein am Ende.
Als Hobby-Chemiker geht das über meine Kenntnisse hinaus. Ich hoffe, Sie können mir weiter helfen!
Identitätsprüfung auf Kaliumpermanganat:
1. Identität auf Permanganat
- Etwa 50 mg Substanz in 5 ml Wasser lösen.
- 1 ml Ethanol 96% und 3 ml verdünnte Natriumhydroxid-Lösung zugeben. Es entsteht eine Grünfärbung.
- Nach Erhitzen zum Sieden: Dunkelbrauner Niederschlag
2. Identität auf Kalium
- Nachweis mit Natriumhexanitrocobaltat(III)
- 1 ml Essigsäure 12% R zugeben
- Nach Zugabe des Reagenzes: gelber bis orangegelber Niederschlag
A: 1) Mangan(VII) im Permanganat-Ion wird in der Kälte durch Ethanol zu
grünem Mangan(VI) reduziert. Aus Ethanol entsteht im Allgemeinen Acetaldehyd.
Reduktion: 2 MnO4- + 2 e- ———> 2 MnO42-
Oxidation: CH3-CH2OH + 2 OH- ———> CH3-CHO + 2 H2O + 2 e-
______________________________________________________________________
Redox: 2 MnO4- + CH3-CH2OH + 2 OH- ———> 2 MnO42- + CH3-CHO + 2 H2O
Wenn man die Mischung erhitzt, wird überschüssiges Ethanol bzw. primär gebildeter Acetaldehyd weiter oxidiert (z. B. zu Acetat), wobei Mangan(IV) als Braunstein ausfällt.
2) Kalium bildet mit löslichem Natriumhexanitrocobaltat(III) einen gelben Niederschlag.
2 KCl (lösl.) + Na3[Co(NO2)6] (lösl.) ———> K2Na[Co(NO2)6] (schwerlösl.) + 2 NaCl (lösl.)
Der Niederschlag besteht übrigens aus kleinen Oktaedern.
1540
F: Ich hab da noch eine weitere Titration, bei denen ich nicht genau weiß, was genau mit wem zu
was reagiert und bitte sie hiermit nochmals um Hilfe.
Gehaltsbestimmung von Salicylsäure
0,120 g Substanz, in Ethanol 96% gelöst, werden nach Zusatz von 20 ml Wasser und 0,1 ml Phenolrot-Lösung mit Natriumhydroxid-Lösung
(0,1 mol/l) titriert.
A: Hier findet eine Säure/Base-Titration statt. Lösemittel ist wegen der schlechten Löslichkeit
von Salicylsäure zunächst Alkohol. Nach dem Lösungsvorgang kann man dann mit Wasser weiter verdünnen.
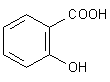
Problematisch ist, dass die Salicylsäure zwei Säuregruppen enthält, deren pKa-Werte aber weit auseinander liegen. Denn auch die OH-Gruppe des Phenols kann Protonen freisetzen.
Der Indikator Phenolrot schlägt zwischen pH 6 und 8,2 von Gelb nach Rot um. Daraus folgt, dass bei der Titration bis zum Umschlagspunkt nur die Carboxylgruppe der Salicylsäure erfasst wird. Die phenolische Hydroxylgruppe dissoziiert nennenswert erst ab pH 9.