 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1546
F: Seit einiger Zeit bemerke ich in meinen Augen Lichtblitze, die völlig ohne Grund
auftauchen. Was kann das sein? Hängt es vielleicht damit zusammen: Ich habe im biochemischen Labor bei der Auswertung von
Elektrophoresen viel mit UV-Strahlung zu tun.
A: Es kann sich (muss aber nicht!) um eine gefährliche Augenkrankheit handeln. So
spricht einiges dafür, dass es sich um eine beginnende Netzhautablösung handelt. Statt Schmerzsignale auszusenden, meldet sich
die mechanisch gestresste Netzhaut mit Irrmeldungen an das Gehirn, was als Blitze registriert wird. Es gibt aber auch harmlosere
Gründe für das Blitzen. Das kann z. B. schwankender Blutdruck sein.
Nachdenklich macht mich jedoch, was Sie von der UV-Strahlung berichten. Eine Kollegin von mir hat nachts eine beidseitige Netzhautablösung mit fast völliger (irreversibler) Erblindung erlebt. Sie hat wie Sie vorher viel mit UV-Strahlung gearbeitet. Ob da ein Zusammenhang besteht, weiß ich nicht. Mir fällt das nur auf…
Auf jeden Fall sollte man eine grundsätzliche Warnung aussprechen: Sie setzen doch Ihre Augen im Labor hoffentlich nicht ungeschützt der UV-Strahlung aus? Man muss bei Arbeiten mit UV-Strahlung grundsätzlich immer eine Schutzbrille tragen, und zwar so eine, die ausdrücklich auch gegen UV-Strahlung abschirmt! Sie muss auch so gebaut sein, dass sie die seitlich eindringende Streustrahlung abschirmt.
Übrigens sollten das auch Briefmarkensammler beachten. Die prüfen ihre Marken oftmals mit UV-Strahlern, sei es auf unterschiedliche Phosphoreszenz-Typen oder auf illegale Reparaturen. Der Gebrauch einer Schutzbrille ist in diesen Kreisen nach meiner Beobachtung eher ungewöhnlich.
Auf jeden Fall ist dringend eine sofortige Kontrolle durch einen Augenarzt zu empfehlen.
1547
F: Wie wird löslicher Kaffee hergestellt?
A: Vorneweg: Diese Kaffeeextrakte haben (außer der raschen Zubereitung des braunen Getränks)
gegenüber dem klassischen Gebräu einen Vorteil: Sie enthalten weniger Coffein und Chlorogensäure. Das
sind Stoffe, die manche Leute nicht vertragen.
Kaffee wird zunächst wie normal geröstet. Dieser Röstkaffee wird unter Druck und Hitze (> 100 °C) mit Wasser extrahiert. Nun muss man das Wasser abtrennen. Das geschieht auf verschiedene Art und Weise. Einmal kann man das Wasser (leider samt der Aromastoffe, die man auffangen muss) abdestillieren. Weitere Verfahren sind das Ausfrieren mit mechanischer Abtrennung der Eiskristalle. Auch Membranverfahren sind bekannt.
Man erhält einen sirupartigen Dicksaft. Den kann man auf verschiedene Weise trocknen: Beispielsweise kann man den Saft in hohen Türmen in heiße Luft sprühen, wobei das Wasser verdampft. Ein anderes Verfahren ist die Gefriertrocknung (Lyophilisation). Man lässt hierzu den Sirup einfrieren und setzt ihn dann einem Vakuum aus, bei dem das Wassereis absublimiert. Heute sind auch Trocknungsverfahren mit Mikrowellen im Gebrauch.
Nun hat man ein feines Pulver, das aber leider kaum nach Kaffee schmeckt. Man muss deshalb die Kaffeearomastoffe zusetzen. Die hat man entweder während des Extrahierens des Röstkaffees und Eindampfens des Primärextrakts aufgefangen. Das entspricht letztlich der Wasserdampfdestillation. Aber man kann das Aroma auch vor dem Extrahieren abtrennen: Bei modernen Extraktionsverfahren arbeitet man mit überkritischem CO2. Letzteres Verfahren heißt auch Destraktion.
1548
F: Kupfer wird mit Lösungen von Eisen(III)-chlorid geätzt? Wie kann das sein?
A: Eisen(III)-chlorid-Lösungen reagieren einmal deutlich sauer. Das liegt daran, dass die
Eisen(III)-Ionen in Lösung als Aquokomplexe vorliegen. Außerdem tragen sie als Liganden auch
noch Chlorid-Ionen. Aufgrund der sauren Wirkung wird der Kupferoxidbelag zersetzt, was zunächst für die Reinigung der Kupferoberfläche
von Vorteil ist. Aber das Kupfermetall selbst wird durch Protonen nicht angegriffen, das heißt, es wird durch Protonen nicht oxidiert.
Beim Ätzen des metallischen Kupfers kommt die oxidierende Wirkung von Eisen(III)-Ionen ins Spiel. Deren Normalpotential (Standard-Redoxpotential) beträgt im sauren Milieu
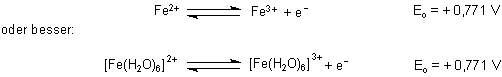
Das Normalpotential von Kupfer ist dagegen geringer.
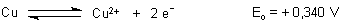
Folglich kann Eisen(III)-chlorid-Lösung Kupfermetall zu Kupfer(II) oxidieren. Sie wirkt somit als Ätzmittel. Das nutzt z. B. dem Kupferstecher oder bei der Herstellung von Platinen in der EDV-Technik. Man könnte hierbei natürlich auch Salpetersäure verwenden, die ist aber zu aggressiv – vor allem auch wegen der gasförmigen Reaktionsprodukte (NO und NO2).
1549
F: Ich habe mich bereits einmal an Sie gewendet und habe nun noch ein Verständnisproblem, da
sich aufgrund verschiedener Informationen aus Büchern bzw. Internet und Angaben meines Kursleiters Widersprüche ergeben. Dass mich
ihre letzte Antwort außerordentlich schnell und umfangreich erreicht hat, hat mich sehr gefreut. Vielen Dank! Das Problem ist folgendes:
Es geht um die Auflösung von Kupfer in Salpetersäure mit einer Konzentration von 65%. Ich bin nach wie vor auf der Suche nach der
ablaufenden Reaktion, da in der Sekundärliteratur meist die Rede vom Kupfer(II)nitrat Cu(NO3)2 als Produkt die Rede ist, mein Kursleiter
allerdings der Überzeugung ist, dass aufgrund des Wasseranteils in 65%iger Salpetersäure das gebildete Kupferion sofort mit Wasser zum
Kupfertetraaquakomplex [Cu(H2O)4]2+ weiterreagiert und nicht zu Kupfernitrat wird.
Deswegen würde ich Sie bitten, mir Aufschluss zu geben, welche Reaktion nun abbläuft, wenn Kupfer mit 65%iger Salpetersäure reagiert.
A: Weder Sie noch Ihr Kursleiter haben Recht. Es bildet sich in dieser konzentrierten
Salpetersäure ein kompliziertes Gemisch aus Komplex-Hybriden, die als Liganden neben Wassermolekülen auch Nitrat- und Nitrit-Ionen
sowie Stickstoffoxide (NO, NO2) enthalten. Hinzu kommen noch Kationen wie NO+.
Ich stimme Ihnen jedoch auf jeden Fall zu, dass man zur Vereinfachung der Redoxgleichungen nur Kupfer(II)-nitrat als Produkt angeben sollte. Das Weiterführende, was Ihr Lehrer vorschlägt, verwischt die eigentliche Information des Redoxprozesses. Er sollte einmal über das Stichwort „Didaktische Reduktion“ nachdenken.
1550
F: Ich habe nach dem Schmieden einer Messerklinge versucht den entstandenen Zunder mit Zitronensäure
zu entfernen. Dies hat auch super funktioniert, jedoch ist dabei ein Geruch nach Eiern entstanden.
Jetzt meine Frage: welcher Stoff könnte sich da gebildet haben, der diesen Geruch verursacht?
Ich hoffe Sie können mir da weiterhelfen.
A: Sie meinen sicherlich den Geruch nach faulen Eiern…
Beim Erhitzen des Eisens in der Esse haben Sie schwefelhaltiges Material reduziert. Z. B. reagiert Sulfat aus der Holzkohle mit dem glühenden Eisen.
4 Fe + K2SO4 ———> 4 FeO + K2S
Beim Ansäuern mit Citronensäure (Abk. citH3) wird aus dem Kaliumsulfid Schwefelwasserstoff freigesetzt. Schematisch kann man das so schreiben:
K2S + citH3 + Wasser ———> K2citH + H2S
Letzterer riecht nach faulen Eiern.