 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1706
F: Anilin ist doch ein Amin. Warum reagiert es fast gar nicht basisch?
A: Genau genommen reagiert Anilin durchaus als Base, aber erst im sauren Bereich,
also wenn der Protonendruck hoch ist. Sein pKa-Wert liegt deshalb bei 4,63. Die protonierte Form, das
Anilinium-Kation, ist somit etwa so sauer wie Essigsäure.
Für die Protonierung von Aminen ist das nichtbindende („einsame“) Elektronenpaar am Stickstoffatom verantwortlich. Dieses steht aber beim Anilin nicht so ohne weiteres zur Verfügung. Denn es ist in die Mesomerie des angrenzenden aromatischen Rings eingebunden. Man spricht von einem +M-Effekt.
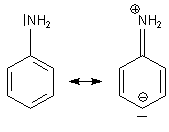
Das Anilinium-Kation bildet sich auf folgende Weise und hat diese Struktur:
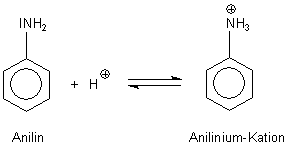
Anilin wirkt in stark alkalischem Milieu sogar als Säure. Das liegt am -I-Effekt des Benzolrings. In diesem Fall bilden sich Anilin-Anionen.
1707
F: Ich bin gerade dabei mein Fachreferat in Chemie über das Thema: "Fällungsreaktionen
als typische Nachweisreaktion für Anionen" vorzubereiten.
Ich soll die Nachweismethode in der Umweltchemie, mit Beispielen in der Abwasserreinigung Mineralwasseranalyse und
Industrieabwasserreinigung, vorstellen. Finde aber nichts. Wäre lieb wenn sie mir dabei helfen könnten.
A: Als umweltschädigende Anionen, die sich durch Fällungsreaktionen nachweisen bzw.
abtrennen lassen, kommen vor allem die Phosphat-Ionen in Frage. Man macht das mit Eisen(III)-
oder Al-Salzen. Technisch setzt man Eisen(II)-salze ein („Grünsalz“), das dann aber im Verlauf der Operation zu Eisen(III) oxidiert
wird. Phosphate schädigen die Umwelt, da sie eutrophierend wirken.
Des Weiteren kann man Halogenid-Ionen mit salpetersauren Silbernitratlösungen nachweisen. Es bilden sich schwerlösliches Silberchlorid, -bromid und -iodid. Sie spielen eine wichtige Rolle als Korrosionsförderer - vor allem für Eisen und Aluminium. Im Trink- oder Schwimmbadwasser wirken sie beim Chloren zusammen mit „Huminstoffen“ und anderen organischen Substanzen (wie Citronensäure) als Bildner von “gemischten Haloformen“, die als cancerogen gelten.
Denkbar ist der Nachweis von (Hydrogen-)Carbonaten, da sie als Wasserhärtebildner wegen der Bildung von Kesselstein stören und darüber hinaus aufgrund ihrer Überzüge an Korrosionsprozessen beteiligt sind.
Weiter ist auch an Schwefelwasserstoff zu denken, der nicht nur giftig istd, sondern wegen der Schwerlöslichkeit seiner Salze (Sulfide) auch die Korrosion vieler, auch edler Metalle wie Silber („Anlaufen von Silber“) fördert.
1708
F: Man sagt, dass im Tabakrauch schädliche Radikale enthalten sind, worauf dessen Giftwirkung
beruhe. Es heißt doch immer, dass Ascorbinsäure (Vitamin C) Radikale wegfängt. Das möchte ich den Schülern nicht nur erzählen, sondern
auch gerne im Experiment zeigen. Ich habe deshalb eine Ascorbinsäurelösung hergestellt und deren Gehalt mit Ihrer Iodat-Methode bestimmt.
Dann habe ich Zigarettenrauch durch die Lösung geleitet. Danach habe ich den Gehalt an Vitamin C erneut bestimmt. Es hat sich trotz der
Radikale nichts verändert! Stimmt Ihre Messmethode nicht?
Kann ich das wenigstens mit anderen Vitaminen wie A oder E zeigen? Die sollen ja auch Radikale abfangen.
A: Die Iodat-Methode funktioniert. Aber Sie machen
etwas falsch: Woher sollen denn die von Ihnen im Zigarettenrauch vermuteten langlebigen Radikale kommen, die Sie durch die Lösung
leiten könnten, damit diese mit Ascorbinsäure reagieren? Denn aus der Zigarettenglut kommt nach Abkühlung kein Radikal ungeschoren
heraus! Das einzige in größeren Mengen vorhandene Radikal, das unter diesen Bedingungen als Zerstörer von Ascorbinsäure in Frage käme,
wäre der Sauerstoff. Daran dürfte wohl auch Mangel herrschen… Wenn Sie statt des Tabakrauchs normale Luft durch eine Ascorbinsäurelösung
geleitet hätten, hätte der Gehalt an Ascorbinsäure sehr wohl etwas abgenommen.
Sie haben insgesamt die Wirkung der Ascorbinsäure falsch lokalisiert: Die viel beschriebene Abwehrrolle gegen Radikale betrifft in
erster Linie unseren Körper und ist letztlich ein komplizierter (bio)chemischer Prozess. Klicke hier.
Vor allem ist der Sauerstoff der böse Bube. Als Biradikal fördert er die Bildung von anderen Radikalen wie Hydroxid HO• oder Hydroperoxid
HOO•. Besonders wichtig ist das Superoxid-Ion -OO•. Sie werden mit Hilfe der Ascorbinsäure weggefangen. Dabei wirkt unterstützend, dass
die Ascorbinsäure ebenfalls Radikale bilden kann.
Außerdem ist Ascorbinsäure Cosubstrat bei vielen biochemischen Redox-Reaktionen, die u. a.
dazu dienen, Verbindungen wie Noradrenalin zu hydroxylieren. Außerdem sind cancerogene
Rauchbestandteile wie die polykondensierten Aromaten (PAK) zu entgiften.
Auch dabei können durch Nebenreaktionen der daran beteiligten Monooxigenase-Reaktion Radikale entstehen.
Das alles können Sie den Kindern leider nicht in einem einfachen Experiment zeigen...
Das Gleiche gilt auch für die Vitamine A und E. Bei denen kommt noch das Problem hinzu, dass Sie über keinerlei für den Schulunterricht geeignete Methoden verfügen, um diese Vitamine auch im Reagenzglas nachzuweisen.
Irgendwo hat auch das Anliegen, einen Unterricht in moderner Chemie zu gestalten, seine Grenzen. Ansonsten wird das ein Unterricht mit Black Boxes (besser: Grey Boxes…) - wie zum Beispiel in diesen Sattelschlepper-Laboren, in denen Realschüler lernen sollen, wie man das Genom eines Neandertalers analysiert.
1709
F1: Ich hätte noch einige Fragen zum Thema Disaccharide, auf die ich auf ihrer Homepage noch
keine Antwort gefunden habe:
1.) Die Lactose besteht ja aus einem Molekül β-D-Galactose und einem Molekül β-D-Glucose, die β-1,4-glykosidisch verbunden sind. Ist die Reihenfolge egal, also ob die Galactose am C1-Atom und die Glucose am C4-Atom verknüpft ist oder anders herum?
2.) Wenn zwei Zuckermoleküle zu einem Disaccharid reagieren, schreibt man dann einen Reaktionspfeil oder einen Gleichgewichtspfeil? (Warum?)
Wo findet diese Reaktion statt? Ich kenne eigentlich nur den umgekehrten Fall, dass die Disaccharide in der Natur vorliegen (z.B.
Saccharose in Zuckerrüben oder -rohr) und dann gespalten werden, entweder enzymatisch oder mit Säure.
Vielen Dank im Voraus. Ich finde ihre Homepage sehr bereichernd!
PS: Es ist noch eine weitere Frage zum Thema Disaccharide aufgetaucht. Und zwar, warum muss bei der Verknüpfung von 2 Zuckermolekülen immer eine halbacetalische OH-Gruppe an der Reaktion beteiligt sein? Warum können nicht auch 2 alkoholische OH-Gruppen miteinander reagieren?
Vlg (…)
A1: Zu 1: Lactose ist ein enzymatisch gebildeter Stoff. Enzyme arbeiten präzise
nur in einer Richtung. Das liegt daran, dass die Edukte (Substrate) vor dem Verknüpfen an das Enzym angelagert werden müssen, sterisch
exakt ausgerichtet werden und dann Wasser abspalten. Die Synthese läuft nur in der Art, wie die Lactose aufgebaut ist, nämlich zu
Galactose-1,4-Glucose.
Zu 2: Grundsätzlich sollte man hier einen einfachen Reaktionspfeil zeichnen, weil diese biochemische Bildungsreaktion
(eine Kondensation) aus energetischen Gründen nur im enzymgebundenen Zustand reversibel ist. Die Edukte sind auch nicht die Monosaccharide,
sondern (zumindest was die halbacetalische Komponente angeht) noch aktiviert durch Anlagerung entsprechender Gruppen wie UMP. Hier liegt
also kein chemisches Gleichgewicht vor, das man bekanntlich durch einen Doppelpfeil charakterisiert.
Wenn man aber ausdrücken will, dass es grundsätzlich (wenn auch über Umwege) möglich ist, die Lactose wieder in ihre Edukte Gal und
Gluc zu spalten, kann man das mit einem Doppelpfeil beschreiben. Dann schreibt man die Reaktionsbedingungen über und unter die beiden Pfeile.
Das heißt aber nicht, dass es da ein reales chemisches Gleichgewicht gibt.
Zu 3: Die halbacetalische OH-Gruppe ist keine Alkoholgruppe, sondern dahinter steckt letztlich eine reaktive Carbonylgruppe - bei Gal und Gluc ist das ein Aldehyd, bei der Fructose ein Keton. Das Carbonyl befindet sich auf einem hohen chemischen Potential und kann deshalb leicht mit einem weiteren Halbacetal (bei der Saccharose) oder mit einem Alkohol (bei Lactose, Maltose…) reagieren.
Auch wenn man es gern anders sagt: Aber zwischen Kohlenhydraten entsteht kein richtiger Ether, sondern ein Vollacetal, das reaktiv bleibt. Deshalb können Di- und Polysaccharide katalytisch auch wieder leicht unter Wasseranlagerung gespalten werden - nicht aber Ether, die aus zwei aliphatischen Alkoholen gebildet werden.
Zwei Alkohole bilden nur unter stärkerem Energieaufwand Ether. Deshalb muss man sie anders herstellen, z. B. aus Alkoholat und Halogenalkanen oder durch Schwefelsäurekatalyse.
Zum Aufbau der Disaccharide und zu den Eigenschaften von Acetalen haben wir Webseiten. Klicke auch hier.
F2: Vielen Dank für die ausführliche Antwort.
1710
F: Schönen Guten Tag Herr Blume,
ich bräuchte dringend noch Informationen zu meiner Facharbeit. Ich schreibe über The World in Dubai. Der Scheich hat aus Umweltgründen
angeordnet beim Bau der Inseln nur Stein und Sand zu verwenden, da Beton und Stahl nicht Umweltfreundlich genug sind.
Meine Frage lautet nun warum den Beton und Stahl negative Auswirkungen auf das Meereswasser bzw. auf die dort vorkommende Pflanzen
und Tierwelt haben soll.
Recherchen im Internet und in der Bücherei haben leider zu keinem Ergebnis geführt.
Über eine Antwort würde ich mich sehr freuen
A: Sand und Steine gibt es in diesem Wüstenstaat zuhauf. Deshalb entfallen das umweltschädigende
Zementbrennen und auch die Stahlherstellung bzw. der Herantransport des Stahls aus fernen Ländern. All das belastet durch CO2-,
SO2- sowie NOx-Ausstoß die Atmosphäre.
Außerdem ist das Meerwasser salzig und warm. Das führt zur raschen Korrosion des Stahls. Die freigesetzten Eisen-Ionen sind ein hervorragender Algendünger; die Algenblüte wird das klare Meer rasch verderben.
Naturgestein wird anders als Betonklötze rasch von Meeresorganismen besiedelt. Die haben da einfach mehr Ansatzpunkte und Nischen zum Verstecken.
Letztlich ist es auch eine optische Frage: Wenn tauchende Touristen ins Meer kommen, werden sie sich in einem natürlich aussehenden Riff wohler fühlen.
Und so weiter!...