 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1946
F: Zunächst einmal vielen Dank, dass Sie diese Kontaktmöglichkeit bieten.
Selbstverständlich freue ich mich auch über Antworten von Ihren Mitarbeitern (ich erwarte hier keine "Chefbehandlung").
Es geht um Folgendes aus Ihrem Webseitenangebot:
http://www.chemieunterricht.de/dc2/fc/v00.htm. Speziell (Zitat):
-------------------
Chemikalien
Natriumhexachloroplatinat(IV) (T). Man kann auch das Kaliumsalz verwenden.
-------------------
Hierzu folgende Frage: Warum empfehlen Sie das Kaliumsalz, obwohl es doch schwer löslich ist?
A: Das Kaliumsalz ist in Wasser und verdünnten Säuren durchaus merklich löslich. Während
der Elektrolyse baut sich sogar nicht gelöster Bodensatz von Kalium-Hexachloroplatinat(IV) ab.
Die von Ihnen angemerkte Schwerlöslichkeit betrifft ausdrücklich Lösungen, die KCl oder NH4Cl im Überschuss enthalten.
Natürlich können Sie auch die Hexachloroplatin-Säure nehmen oder herstellen. Im Laboralltag hat man meistens die Salze zur Verfügung.
Meine Anmerkung wegen des Kaliumsalzes betrifft sparsame Experimentatoren, die nach Versuchen zum Nachweis von Hexachloroplatinat(IV) bzw. Kalium das angefallene Salz nicht verworfen, sondern in die Chemiesaal-Sammlung gegeben haben.
1947
F: Zunächst zu mir: Ich bin Chemiestudent im 3. Semester (im Sommer steht das Vordiplom an), Physik
haben wir in Vorlesung und Praktika abgeschlossen, in der Physikalischen Chemie befassen wir uns zurzeit in Vorlesung, Praktikum und Seminar
mit Schrödinger, Orbitalen, Wellenfunktionen, Aufenthaltswahrscheinlichkeiten etc.
Zu meinem Anliegen: Elektromagnetische Strahlung besitzt sowohl Wellen- als auch Teilcheneigenschaften. Allerdings ist mir diese Unterteilung
seit PC nicht mehr so ganz klar. Der Leary/Skoog (Lehrbuch der intrumentellen Analytik, Springer-Verlag, 4. Auflage) betrachtet zunächst die
Welleneigenschaften, also Interferenz, Reflexion, Beugung, Brechung und Streuung. Daran schließt sich die quantenmechanische Betrachtung zu
den Teilcheneigenschaften an. ABER: Elektronen werden durch Wellenfunktionen beschrieben, bzw. ihre größte Aufenthaltswahrscheinlichkeit. Die
Absorption beruht darauf, dass die Energie anregender Photonen genau der Differenz zweier Niveaus entspricht. Diese Beschreibung klingt für
mich nach Resonanz; was ich wiederum nur aus der Beschreibung von (gekoppelten) Pendeln kenne, die ja ebenfalls mit Sinus-Wellen beschreibbar
sind.
Warum also teilt man in Wellen- und Teilcheneigenschaften, wenn Teilchen doch ebenfalls durch Wellen beschreibbar sind?
A: Man nimmt immer die Theorie, die gerade zur jeweiligen praktischen Anwendung passt: In der
instrumentellen Analytik ist es besser, mit Lichtwellen zu arbeiten. Damit kann man z. B. die Dispersion von weißem Licht an einem Gitter
erklären. In der Chemie oder Elektrotechnik nimmt man Elektronen gerne als Teilchen an. Bei Abbildungen mit einem Elektronenmikroskop steht
wieder der Welle-Aspekt im Vordergrund. Man muss sich klar sein, dass die Dispersion am Beugungsgitter in einem Fotometer natürlich auch anhand
der Teilchentheorie (Photonen) erklärt werden kann.
Die Deutung der Phänomene, die Sie ansprechen, durch Resonanz ist völlig „out“. Die Theorie gekoppelter Pendel war bis in die 1960er Jahre tatsächlich hilfreich, und ich habe diese auch noch kennengelernt. Heute hat man sich von derlei großphysikalischen Modellen verabschiedet. Auch die Unterteilung in Wellen- und Teilcheneigenschaften wird nur noch benötigt, um Einzelphänomene aufgrund unseres begrenzten Vorstellungsvermögens handlich zu deuten - wie z. B. den photoelektrischen Effekt (Teilchen) oder die Interferenzmuster (Welle). Mathematisch macht das keinen Sinn, einen Gegensatz zwischen Teilchen und Wellenpaket zu konstruieren. Vor allem betrifft das das Verhalten von Teilchen, die einzeln (!) beim Durchgang durch einen Spalt oder sogar durch zwei Spalten Interferenzmuster zeigen. Das lässt sich nur durch die Anschauungen der Quantenmechanik erklären, die keinen Unterschied mehr zwischen Partikeln und Wellen macht. Hilfreich ist dabei die Ansicht von de Broglie, aber auch die Heisenbergsche Unschärferelation.
Ich kann und will Ihnen jetzt keine Vorlesung über die Grundlagen der Quantenchemie geben. Das Beste ist, wenn Sie Kontakt zu Ihren Dozenten aufnehmen und das Problem vielleicht im größeren Rahmen klären (lassen).
1948
F: Mir ist vor ein paar Tagen die Frage in den Kopf gekommen: "Wieso ist Seifenschaum eigentlich weiß?"
Im Internet konnte ich keine passende Erklärung finden deshalb dachte ich, ich wende mich an sie. Es hat vermutlich was mit der Brechung
des Lichts zu tun, aber wie kann ich mir das vorstellen. Bunte Seife bildet ja auch weißen und nicht bunten Schaum. Noch eine weitere Frage
ist "warum verliert die Seife in Meerwasser ihre Wirkung?" hat das mit einer Überkonzentration an Na(+)-Ionen zu tun? Hauptbestandteil
von Meereswasser ist ja NaCl.
A: Seifenschaum ist nicht weiß, sondern genau genommen farblos. Zum Unterschied: Weiß ist eine
Mischfarbe, farblos ist die Abwesenheit von Farbigkeit. Er ist farblos, weil Seife und Wasser farblos sind, also keine Lichtabsorption
zeigen. Hinzu kommt eine gewisse bläuliche Opaleszenz, weil es sich nicht um echte Lösungen, sondern um kolloidale Lösungen handelt. Das
alles lässt den geringen Farbstoffanteil von gefärbten Seifen verschwinden. (Mehr Farbe in der Seifenlösung müsste allerdings als Schmutz,
den man in das zu reinigende Objekt einträgt, definiert werden.)
Allerdings zeigen Seifenblasen aufgrund anderer optischer Effekte (Brechung, Mehrfachreflexion, Interferenzen) deutliche Anlauffarben, die an die von Regenbogen erinnern. Klicken Sie hier.
Damit Seifenschaum entsteht, müssen in der Lösung freie Seifenmoleküle (genauer: Fettsäure-Anionen) vorliegen. Nur diese haben die grenzflächenaktiven Eigenschaften von Tensiden, die zur Blasenbildung führen. Dass das mit Meerwasser nicht funktioniert, liegt an den im Meerwasser reichlich vorhandenen Härtebildnern Magnesium und Calcium, die mit den Seifen-Anionen schwerlösliche Verbindungen bilden (sog. Kalkseifen). Diese haben keine Tensideigenschaften mehr. Klicken Sie hier.
Natrium- und Kalium-Ionen sind zwar auch reichlich vorhanden; deren Verbindungen mit den Seifenanionen sind jedoch leicht löslich. Kernseife ist z. B. das Natriumsalz der Fettsäuren, deren Anionen die Tensidmoleküle bilden.
Moderne Seifen beruhen nicht mehr auf Fettsäuren, sondern auf Sulfonsäuren bzw. Schwefelsäureestern. Diese reagieren nicht mit den Härtebildnern und schäumen deshalb auch mit Meerwasser.
1949
F: Betreff: spontaner Temperaturanstieg beim Glühen von Zinn
Beim Glühen von dünnen Zinnplatten bei ca. 150 °C unter Stickstoffatmosphäre steigt regelmäßig nach ca. 3-4 Stunden die Temperatur
um ca. 10 – 15 °C an. Die einzelnen Zinnplatten werden durch Kupferplatten getrennt. Hierfür habe ich leider keine Erklärung. Kann es
sein das durch eine eventuelle Umwandlung der Phasen im Zinn eine exotherme Reaktion stattfindet? (Ähnlich wie bei der Bildung von a-Zinn
bei der Zinnpest.) Bei dem Zinn handelt es sich um eine Legierung mit über 96% Zinn, etwas Antimon, etwas Zink und etwas Blei. Ich hab
für dieses Material leider kein passendes Zustandsdiagramm gefunden.
Können sie mir bei diesem Phänomen bitte weiterhelfen?
A: Ich gehe davon aus, dass Sie die Platten zusammen mit dem Kupfer erhitzen. Es wird sich
um die exotherme Bildung der Legierung Bronze handeln, die an den Grenzflächen abläuft.
1950
F: Wie sieht die Benzolstruktur aus? Da habe ich eine Benzolstruktur gefunden mit einem Oval drin,
es fehlen m. E. die Doppelbindungen bzw. deren Symbolik! Dazu ist das Oval noch rosa eingefärbt!
A: Ich gehe davon aus, dass Ihre Frage diese beiden Darstellungsformen betrifft:
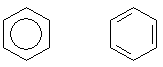
Wegen des allgemeinen Interesses haben wir hierzu eine Webseite gemacht. Klicke hier.