 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1941
F: Wir haben ein im alten Stil gefertigtes Möbelstück gekauft. Jetzt haben wir festgestellt, dass
das penetrant nach Essig riecht. Wie kommt das? Kann man dagegen etwas unternehmen?
A: Die auf alten Landhaus-Stil getrimmten Möbel werden meist aus Coniferenholz gefertigt. Wenn
man genau hinsieht, erkennt man, dass die aus altem Holz bestehen. Manchmal erkennt man sogar noch die Holzwurmlöcher. Hinzu kommt, dass
die Holzplanken nicht zusammenpassen, also zusammengestückelt worden sind. (Die Holzwurmlöcher gehen z. B. nicht von einer Planke in
die nächste…)
Es handelt sich um alte Hölzer aus alten Möbeln oder Abrisshäusern. Diese waren meist mit Farbe oder Firnis behandelt. Um die Hölzer abzubeizen, bedient man sich Laugen wie der Natronlauge. Diese hydrolysiert die Esterbindungen der Ölfarben. Außerdem lässt die Lauge das Holz aufquellen.
Um die Natronlauge wieder zu entfernen, reicht Spülen nicht aus. Man muss sie neutralisieren. Dazu könnte man Salzsäure nehmen - die aber als starke Mineralsäure das Holz schädigt. Man verwendet stattdessen Essigsäure. Diese hat aber den Nachteil, dass sie stark vom Holz adsorbiert wird, erst nach und nach abdampft und dadurch dem Möbelstück eine penetrante Duftnote verleiht. So hat man lange etwas davon.
Dagegen kann man als Laie nichts tun. In der Industrie könnte man das Holz vor der Verarbeitung einige Tage in eine Vakuumkammer legen, in der sich konzentrierte Laugen befinden (wie bei einem Exsikkator). Der Unterdruck fördert das Abdampfen der Essigsäure, die dann durch die ausstehenden Laugen aufgefangen und so geruchsfrei entsorgt wird.
1942
F: Recht herzlichen Dank für das freundliche Telefonat hinsichtlich der Verwendung von blauen
Kornblumenblütenblättern!
Können sie mir sagen, welche möglichen Anwendungen (außer als Schmuckdroge im Tee) die Kornblumenblütenblätter haben könnten?
A: Es gibt keine technischen Anwendungen, z. B. zum Färben von Stoffen oder anderen Medien.
Dazu ist die Farbstoffgruppe der Anthocyane, zu denen das Kornblumenblau („Cyanin“) gehört, zu empfindlich. So wird sie leicht durch
Oxidation angegriffen. Auch ändert sie ihre Farbe bei Änderungen des pH-Werts. Schon im schwach alkalischen Milieu wird der Farbstoff
zerstört, was erst zur Gelb- und dann durch Oxidation zur Braunfärbung führt. In schwach saurem Milieu werden Wassermoleküle gebunden,
was zur langsamen Entfärbung führt. Außerdem sind die Farbstoffe nicht lichtecht, werden also durch das UV der Sonne zerstört.
Zur Chemie des Farbstoffs, der auch in der roten Rose sowie im Rotkohl vorkommt, klicken Sie hier.
1943
F: Gestern ist in der Nachbarschaft ein Blitz eingeschlagen. Wir haben Brandgeruch erwartet,
stattdessen aber roch es deutlich nach Chlor. Wie kann Chlor entstehen?
A: Hoffentlich haben Sie vom Lärm keinen Ohrschaden davongetragen, obwohl ein Diskobesuch
heute mehr Phon auf die Reihe bringt…
Sie haben Recht, dass es nach Chlor riechen kann, wenn ein Blitz einschlägt. Manche Leute sagen auch, dass sie den Geruch wahrnehmen, wenn es am Himmel sehr viele Blitze gibt, ohne dass diese in ihrer Nähe einschlagen. Nun muss es aber kein Chlor sein, wenn es nach „Chlor“ riecht. Im Falle der Blitze handelt es sich bei der Ursache für den Geruch um Stickoxide („NOx“). Stickoxide entstehen durch die so genannte Luftverbrennung, bei der Sauerstoff und Stickstoff miteinander reagieren.
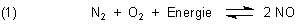
Dazu ist eine große Energie notwendig. Die steht im Blitz in ausreichendem Maße zur Verfügung.
In einer Folgereaktion wird Stickstoffoxid NO zu Stickstoffdioxid NO2 oxidiert. Diese Reaktion erfolgt spontan.
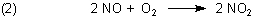
Stickstoffdioxid ist der Stoff, der nach Chlor riecht.
Den Chlorgeruch stellen Sie auch fest, wenn Sie die Auspuffgase eines Dieselmotors riechen. Auch hier sind die Stickoxide die Verursacher. Zwar ist die Energie in einem Dieselmotor nicht so hoch wie in einem Blitz. Aber dafür ist der Druck wesentlich höher, was vor allem auch die Folgereaktion (2) zur Bildung von NO2 betrifft. Hinzu kommt, dass die heißen Metallteile im Motor katalytisch wirken.
Zur Chemie der Stickoxide haben wir eine Webseite.
1944
F: Hallo Professor Blume Team!
Ich habe eine dringende Frage: und zwar geht es um die Redoxreaktion bei Oxidationshaarfarben.
Ich finde keine angemessene Reaktionsgleichung zu einem Farbstoff, bei der Wasserstoffperoxid als Oxidationsmittel fungiert, dabei
bräuchte ich dringend eine Redoxreaktionsgleichung mit Oxidationszahlen, um zu beweisen, dass es sich um eine Oxidation handelt.
Das Problem ist leider, dass ich entweder immer nur Texte finde, in denen die Reaktion oberflächlich beschrieben wird, oder so
detailliert, dass ich es leider nicht mehr verstehe (z.B. in Doktorarbeiten).
Am Donnerstag halte ich meine GFS (Referat, das wie eine Klassenarbeit zählt) und ich bräuchte die Gleichung dringend für den Vortrag.
Ich besuche die 12. Klasse eines Gymnasiums und habe Chemie als Leistungsfach (bin auch ziemlich gut), aber ich hätte doch gern eine relativ
leicht verständnisvolle Reaktionsgleichung mit Oxidationszahlen(!), die nicht aus einer Doktorarbeit stammt.
Wenn ihr mir helfen könntet, wäre ich euch echt dankbar.
A: Hier berichten wir über die chemischen Reaktionen beim oxidativen
Haarefärben und ganz speziell hier.
Bei den komplizierten Formeln der Haarfarbstoffe sollte man gar nicht erst versuchen, eine Oxidationszahl anzugeben. Besser ist es, wenn man darauf hinweist, dass durch H2O2 von der Farbstoffvorstufe (z. B. dem Entwickler Phenylendiamin) zwei Wasserstoffatome samt Elektron abgespalten werden. Das kann man als Oxidation deuten.
Zum Redoxverhalten von Wasserstoffperoxid samt Reaktionsgleichungen haben wir auch eine Webseitengruppe.
1945
F: Betreff: spezifische Nachweisreaktionen zur Unterscheidung von Aminosäuren und Proteinen
Gibt es abgesehen von der Biuret-Reaktion noch weitere Nachweisreaktionen, mit denen man Lösungen von Aminosäuren von Proteinlösungen
unterscheiden kann? Die Ninhydrin-Reaktion sollte vom Reaktionsmechanismus her eigentlich nur bei Aminosäuren funktionieren, allerdings
habe ich im Internet wie auch auf dieser Homepage viele Anleitungen gesehen, bei der Eiklar für den Versuch verwendet wird - anscheinend
reichen schon die wenigen freien Aminogruppen bei Proteinen für einen positiven Nachweis aus?
Kennen Sie vielleicht noch andere experimentelle Unterscheidungsmöglichkeiten zwischen einzelnen Aminosäuren und Proteinen?
Vielen Dank und ein großes Lob für die tolle Website!
A: Im Eiklar sind zwar auch freie Aminosäuren enthalten, die wie bekannt mit
Ninhydrin reagieren. Aber auch Peptide und Proteine reagieren - wenn auch in geringerem Umfang.
Das ist bei der Vielzahl von funktionellen Gruppen, die zur Primärreduktion des Ninhydrins führen können, verständlich. Immerhin
gibt es mit verschiedenen Aminosäuren bereits unterschiedliche Farbtöne, die von Gelb über Purpur nach Blau reichen können.
Deshalb ist Ninhydrin zwar geeignet, um bei der Elektrophorese Aminosäureflecke aufzuspüren - aber es ist keineswegs Nachweisreagenz auf Aminosäuren!
Nasschemisch ist die Unterscheidung zwischen einzelnen Aminosäuren und Proteinen also nicht möglich. Hier muss man apparativ vorgehen, z. B. mit Chromatografien (HPLC), Elektrophoresen oder Massenspektrometrie.