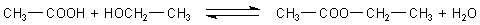
Säurekatalysen. Der Feinmechanismus der katalysierten
Estersynthese bzw. Esterspaltung; Verseifung
Experimente:
Versuch: Schwefelsäurekatalyse bei der Estersynthese
Versuch: Estersynthese und Esterspaltung
Versuch: Darstellung von Estern mit Ionenaustauschern
Versuch: Demonstration der Einstellung der Gleichgewichtslage bei Estersynthese und Esterspaltung
Ester sind Kondensationsprodukte aus Säuren und Alkoholen.
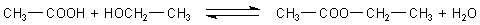
Bei der Estersynthese handelt es sich um ein chemisches Gleichgewicht.
Sind Säuren die Katalysatoren?
Die klassische Estersynthese ist eine Säurekatalyse. Säuren katalysieren also
nicht nur die Synthese, sondern auch die Esterspaltung. Um die Synthese
voranzutreiben, entfernt man eines der Produkte. Den Ester kann man
abdestillieren, weil er im Allgemeinen einen niedrigeren Siedepunkt hat als die
Edukte: Ethanol 78,3 °C, Essigsäure 118 °C, Essigsäureethylester 77,1 °C. Man
kann aber auch das Wasser mit einem Apparat, dem Wasserabscheider, entfernen.
Im Schulbetrieb hat sich die Schwefelsäure als Katalysator eingebürgert (-> Versuch). Diese sorgt als hygroskopischer Stoff gleichzeitig dafür, dass auch das Wasser aus dem Estergleichgewicht entfernt wird, so dass eine Gleichgewichtsverschiebung erfolgt. Dadurch wird die Schwefelsäure mit der Zeit verdünnt und unbrauchbar. Das führt immer wieder zur Diskussion, ob die Schwefelsäure überhaupt Katalysator ist. Denn die klassische Definition eines Katalysators ist schließlich, dass er unverändert aus der Reaktion, die er katalysiert, hervorgeht.
Als Katalysatoren wirken allein die Protonen der Säuren
Das macht sich schon dadurch bemerkbar, dass die katalytische Wirkung einer
Säure von deren Dissoziationsverhalten abhängt. Je schwächer sie ist, desto
geringer ist auch die Geschwindigkeit der Gleichgewichtseinstellung.
Statt Schwefelsäure nimmt man gern Chlorwasserstoff, den man in das Gemisch
hineinleitet. Damit arbeitet man möglichst wasserarm.
Schwefelsäure hat den Nachteil, dass sie mit organischem Material verschmutzt ist.
Verdünnte Schwefelsäure aufzuarbeiten ist nicht ganz unproblematisch. Deshalb
haben sich heute Verfahren zur Abfallvermeidung durchgesetzt, bei
denen man statt löslicher Säuren saure Kationenaustauscher als Katalysatoren
nimmt (-> Versuch).
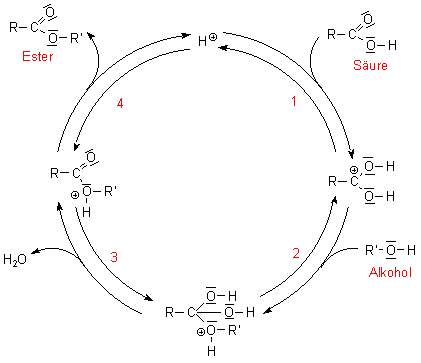
Katalyse-Kreisprozess bei der Veresterung
Der Mechanismus der Protonenkatalyse
Bei der Estersynthese handelt es sich um eine Substitution des Hydroxyl-Restes der
Caboxylgruppe der Säure durch einen Alkoholat-Rest. Der Sauerstoff der
Esterbindung stammt also aus dem Alkohol.
(1) Ein Proton bindet zunächst an ein freies Elektronenpaar des
Carbonylsauerstoffs. Damit wird die Carbonylgruppe stark aufpolarisiert.
(2) An das positivierte C-Atom bindet nukleophil der Sauerstoff des Alkohols. Damit
bekommt das O-Atom eine positive Ladung.
(3) Zwei OH-Gruppen darf es an einem C-Atom normalerweise nicht geben
(Erlenmeyerregel). Deshalb spaltet ein Wassermolekül ab.
(4) Der Wasserstoff der Hydroxylgruppe des Alkohols spaltet als Proton ab,
wodurch der Ester gebildet wird.
Es ist einsichtig, dass diese Reaktion auch rückwärts laufen kann. Denn die Basizitäten von Wasser und von Alkohol sind ähnlich groß.
Es fällt auf, dass strenggenommen ein anderes Proton zurückgebildet wird als das, das die Katalyse eingeleitet hat. Trotzdem ist es eine Katalyse, denn es geht hier um die Stoffbilanz.
Übrigens ist die Protonenkatalyse ein schönes Beispiel für den Sinn und die Notwendigkeit des Säure/Base-Konzepts von Brönsted.
Die alkalische Esterspaltung ist keine Katalysereaktion
Ester kann man durch alkalisches Medium spalten (-> Versuch).
Man spricht von Verseifung. Hierbei handelt es sich um eine Substitution des
Alkoholat-Restes durch ein OH--Ion. Diese Ionen sind also keine Katalysatoren,
sondern Reaktionspartner. Anders als die Alkoholmoleküle bedürfen sie zum Andocken an die
Esterbindung keine Polarisierung der Carbonylgruppe, da sie stark polar sind. Man kann auch
sagen, dass sie stärkere Basen sind.
Außerdem werden die Hydroxid-Ionen bei der Esterspaltung verbraucht, denn es
bilden sich nicht die Säuren, sondern deren Salze.
Die Anionen sind wegen der negativen Ladung des Säurerestes nicht in der Lage,
erneut Ester zu bilden. Deshalb liegt bei der alkalischen Verseifung kein merkliches
chemisches Gleichgewicht vor.
Hier ist eine gute, für die Schule geeignete Vorschrift, um das Estergleichgewicht quantitativ zu demonstrieren (-> Versuch).
Weitere Texte zum Thema „Katalyse“