Chemische Besonderheiten der Kohlenhydrate - Alles eine Frage der Struktur
Experimenteliste zu den Kohlenhydraten
Um zu verstehen, warum es so viele Kohlenhydrate gibt und warum sie so unterschiedlich
reagieren oder schmecken, warum sie als Biomoleküle so unterschiedliche Funktionen haben,
muss man sich mit ihrer Struktur befassen. Alle scheinen gleich zusammengesetzt zu sein:
Sie tragen jeweils eine Carbonylfunktion und dazu Hydroxylgruppen.
Es gibt viele Isomere. Allein von den Hexosen kennt man 12 Isomere, von den Pentosen 6,
Tetrosen 3 und dazu noch zwei Triosen - also 23. Dazu gesellen sich noch die Spiegelbildisomeren.
Fasst man alle zusammen, so haben wir es mit 45 Isomeren zu tun. (Eine Triose, das
Dihydroxyaceton, ist keine chiale Verbindung.)
Zucker wie die Desoxyribose oder Aminozucker haben wir dabei gar nicht berücksichtigt.
Oder Zucker wie die Heptosen, die bei der Fotosynthese oder Gluconeogenese eine wichtige
Rolle spielen.
Was ist ein Chiralitätszentrum?
Das Wort chiral kommt aus dem Griechischen und bedeutet soviel wie "Händigkeit".
Betrachtet ihr eure Hände, so stellt ihr fest, dass sie aussehen wie Bild und Spiegelbild. Sie
sind zwar deckungsgleich, dass heißt sie passen aufeinander, aber sie sind nicht gleich. Eure
Hände sind chiral.
Dasselbe kann auch bei Molekülen vorkommen.
Diese beiden Moleküle sind chiral, denn auch sie verhalten sich wie Bild und Spiegelbild. Diese Eigenschaft ist auf die räumliche Struktur des Tetraeders zurückzuführen. Das in der Mitte liegende Atom ist das Chiralitätszentrum.
Chiralität kann immer nur dann auftreten, wenn an einem Atom vier unterschiedliche Substituenten gebunden sind und sich dadurch die Möglichkeit einer räumlich unterschiedlichen Anordnung ergibt. Dieses C-Atom nennt man deswegen asymmetrisches Atom. Verbindungen, die sich nur durch die Anordnung der Substituenten um ein oder mehrere Chiralitätszentren unterscheiden, bezeichnet man auch als Stereoisomere.
Das Phänomen der Chiralität gibt es auch bei Kohlenhydraten. Jedes Atom der Kohlenstoffkette, mit Ausnahme des ersten und des letzten C-Atoms, kann über ein Chiralitätszentrum verfügen. Weitere bekannte Beispiele aus der Biochemie sind die Aminosäuren.
Was sind Enantiomere?
Unterscheiden sich zwei Verbindungen lediglich durch die Anordnung der Substituenten am
Chiralitätszentrum voneinander, werden sie Enantiomere genannt. Ein Beispiel
hierfür ist das einfachste Kohlenhydrat, Glycerinaldehyd.
Ein Hilfsmittel für die Feststellung der Anordnung der Substituenten um ein Chiralitätszentrum
ist die Fischer-Projektion. Hierbei wird das dreidimensionale Molekül in einer
Ebene, also planar dargestellt.
Da Glycerinaldehyd nur ein asymmetrisches C-Atom besitzt, gibt es auch nur zwei mögliche Varianten der Substituentenanordnung und somit zwei mögliche Enantiomere. Sie werden mit den Symbolen D (lat. dexter, rechts) und L (lat. laevus, links) bezeichnet. Beim Glycerinaldehyd bezeichnet man damit die absolute Stellung der Hydroxylgruppe.
Woher weiß man eigentlich, bei welcher der beiden Formen die OH-Gruppe rechts oder links steht? Dazu haben wir eine Extrawebseite.
Nun gibt es auch Moleküle mit mehreren Chiralitätszentren. Beispiel ist die Glucose. Nur wenn sich ihre Moleküle in allen Chiralitätszentren wie Bild und Spiegelbild verhalten, sind sie Enantiomere. Die Enantiomerie betrifft somit das gesamte Molekül. So gibt es die D- und die L-Glucose.
Was sind Diastereomere?
Bei Verbindungen, die mehr als ein Chiralitätszentrum besitzen, besteht die Möglichkeit, dass sie sich
nicht in allen Zentren unterscheiden, d. h. es können Anordnungen entstehen, die sich nicht wie Bild und
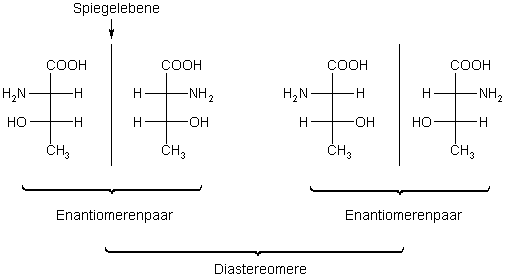
Spiegelbild verhalten. Zur Verdeutlichung betrachten wir die Aminosäure Threonin.
Von der gibt es vier Stellungsisomere, da sie zwei Chiralitätszentren besitzt.

Stereoisomere von Threonin
Die natürlich vorkommende L-Aminosäure hat die zweite Struktur von rechts. Das Symbol L bezieht sich auf die Aminogruppe.
Von denen verhalten sich jeweils zwei wie Bild und Spiegelbild. Diese beiden Gruppen lassen sich aber nicht aufeinander abbilden. Man nennt sie Diastereomere.
Das sind Stereoisomere, die sich nicht wie Bild und Spiegelbild verhalten. Sie besitzen damit auch unterschiedliche Strukturen, was sich wiederum auf ihre chemischen und physikalischen Eigenschaften auswirkt.
Bekannte Beispiele für Diastereomere aus der Zuckerchemie sind a-D-Glucose und ß-D-Glucose, die sich nur in der Stellung der OH-Gruppe am C-Atom 1 unterscheiden. Man nennt sie Anomere. Sie sind chemisch äußerst verschieden. Aus a-D-Glucose baut die Pflanze Stärke auf, aus ß-D-Glucose macht sie Cellulose.
Was sind Epimere?
Unter Epimeren versteht man zwei Diastereomere, die sich lediglich durch die
Stellung der Substituenten am Chiralitätszentrum am C-Atom 2 unterscheiden (Griechisch
epi, auf, darüber, die Spitze betreffend). Die bekanntesten Beispiele hierfür sind die
Kohlenhydrate D-Glucose und D-Mannose, die sich nur am C-Atom 2 unterscheiden. Fructose gehört
nicht dazu, denn sie hat kein Chiralitätszentrum in C2.
Epimere zeichnen sich dadurch aus, dass sie identische Osazone
bilden. Daher stammt letztlich auch ihre Bezeichnung.
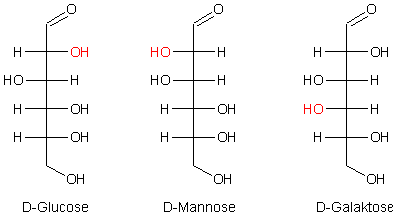
Manchmal wird auch das Paar D-Galaktose und D-Glucose als epimer bezeichnet. Sie unterscheiden sich nur am C-Atom 4, sind also diastereomer. Jedoch bilden sie unterschiedliche Osazone.
Was ist eine meso-Form?
Es gibt noch eine weitere Form der Stereoisomere und zwar die Mesoverbindungen. Betrachten wir
zunächst auch erst ein bekanntes, historisch bedeutsames Beispiel: Weinsäure.
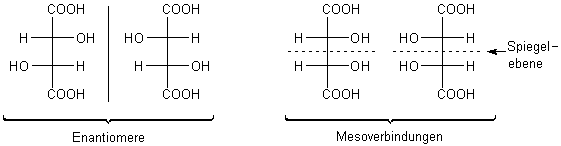
Strukturisomere der Weinsäure
Mesoverbindungen enthalten zwei oder mehr Chiralitätszentren. Ihre Moleküle sind jedoch deckungsgleich mit ihrem Spiegelbild. Sie sind also identisch. Der Grund: Sie besitzen eine intramolekulare Spiegelebene, die es möglich macht, die eine Hälfte auf der anderen abzubilden und somit das eine Chiralitätszentrum auf das andere zu spiegeln. Zwei Mesoverbindungen sind also keine Enantiomere, obwohl sie auf dem ersten Blick so aussehen.
Dazu gibt es aus dem Alltag ein Beispiel: Die schlichte Tasse ist eine meso-Form. Es gibt also keine Tassen für Linkshänder, wie man manchmal scherzhaft meint. Scheren dagegen gibt es für Links- und Rechtshänder zu kaufen!
Ein Beispiel aus der Zuckerchemie ist das Oxidationsprodukt der Galactose, die Schleimsäure.
Mehr zur Stereoisomerie und zur genauen Nomenklatur findet
man hier:
Schneckenkönige und die Händigkeit von Molekülen
Für Spezialisten: Beschreibung chiraler Moleküle nach Cahn-Ingold-Prelog
Weitere Texte zum Thema „Kohlenhydrate“