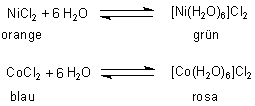
Woran erkennt man, dass sich ein Komplex gebildet hat?
Experimente:
Versuch: Dehydratisierung und Rückbildung von Aquakomplexen
Versuch: Auflösen eines schwerlöslichen Niederschlags durch gleichionigen Zusatz
Versuch: Änderung des Ionenwanderungssinns im elektrischen Feld durch Komplexbildung
Die Bildung von Komplexverbindungen erkennt man oftmals an der charakteristischen
Änderung von bestimmten Substanzeigenschaften wie Farbe, Löslichkeit oder elektrischer
Leitfähigkeit der Lösungen. Diese Änderungen sind von großer Bedeutung für die chemische
Analytik, Technik oder
Medizin.
1 Farbwechsel
Neben dem Kupfersulfat verändern auch andere Salze
ihre Farbe
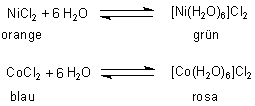
Diese Reaktionen sind wie beim Kupfer(II)-sulfat reversibel.
 |
 |
| Wasserhaltiges und wasserfreies
Nickelchlorid |
Wasserhaltiges und wasserfreies
Cobaltchlorid |
| (Fotos: Sandra) | |
Cobaltchlorid findet u. a. auch Verwendung als Indikator beim Trockenmittel Silicagel ("Blaugel"). Durch den Farbumschlag von Blau nach Rosa wird angezeigt, dass das Trocknungsvermögen des Silicagels erschöpft ist.
2 Änderung der Löslichkeit
Gibst du zu einer Silbernitratlösung verdünnte Salzsäure, so
bildet sich schwerlösliches, weißes Silberchlorid. Durch Zugabe
von konzentrierter Salzsäure im Überschuss beginnt sich
der Niederschlag wieder aufzulösen (-> Versuch).
Was ist hier passiert?
Es ist eine neue Verbindung entstanden, bei der anstatt
einem nun zwei Chlorid-Ionen an das Silber-Ion gebunden sind,
und die offensichtlich eine bessere Löslichkeit besitzt,
als das einfache Silberchlorid. Auch hierbei handelt es sich
um eine Komplexverbindung.
![]() AgCl
AgCl
![]() [AgCl2]-
[AgCl2]-
3 Änderung der elektrischen Leitfähigkeit
Schau dir einmal die Formel des gelben Blutlaugensalzes an:
K4[Fe(CN)6]
Diese Verbindung besteht aus vier K+-Ionen, einem Fe2+-Ion und sechs CN--Ionen. Damit müsste die Leitfähigkeit einer Lösung von gelbem Blutlaugensalz eigentlich der Summe der Leitfähigkeiten der Einzel-Ionen entsprechen und sehr hoch sein. Doch in Wirklichkeit agiert das [Fe(CN)6]4- als einzelnes Ion, als Komplex-Ion. (Es heißt Hexacyanoferrat(II)-Ion.) Somit verringert sich die Leitfähigkeit bei der Komplexbildung, da sich auch die Anzahl der freien Ionen verringert.
Fe2+ + 6 CN-
![]() [Fe(CN)6]4-
[Fe(CN)6]4-
Wie du an der Formel sehen kannst, ändert sich bei dieser Reaktion auch der Ionenwanderungssinn im elektrischen Feld. Die zuvor positiv geladenen Eisen(II)-Ionen sind nun in einer festen Einheit gebunden, die eine negative Ladung besitzt. Dies lässt sich an einem einfachen Versuch demonstrieren.
4 Magnetische Eigenschaften
Eine weitere charakteristische Änderung betrifft die magnetischen
Eigenschaften der Komplexe, die wir in einer besonderen Webseite
besprechen.
Weitere Texte zum Thema „Komplexverbindungen“