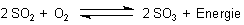
Die Schwefelsäure-Herstellung im Überblick
Vitriolverfahren
Dieses uralte Verfahren beruht auf dem Erhitzen von
Eisen(II)- oder anderen Schwermetallsulfaten. Dabei werden zunächst Wasser, dann Schwefelsäurehydrate
und schließlich auch SO3 angedampft (-> Webseite).
Man erhielt ein Öl, eine hochkonzentrierte Schwefelsäure. Das Verfahren ist heute nur noch von
historischem Interesse.
Die Probleme
In wässriger Lösung lässt sich zwar schweflige Säure oxidieren, aber man erhält dabei keine
konzentrierte Schwefelsäure. Man versuchte deshalb bald, SO2 zu SO3 aufzuoxidieren.
Das Problem ist, dass Schwefeldioxid nicht ohne weiteres zum für die Schwefelsäureproduktion notwendigen
Schwefeltrioxid oxidiert werden kann. Das liegt u. a. daran, dass sich dabei ein chemisches Gleichgewicht
aufbaut.
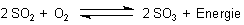
Die Reaktion ist exotherm. Leider beginnt ab 400-600 °C die Rückreaktion. Bei diesen Temperaturen ist die Reaktionsgeschwindigkeit der SO3-Bildung noch zu gering, weil die Reaktion gehemmt ist und stark aktiviert werden muss. Deshalb muss man mit Hilfe von Katalysatoren die Aktivierungsenergie senken.
Bleikammerverfahren (1736)
Bei diesem ebenfalls veralteten Verfahren wurde Schwefeldioxid
SO2 durch Stickoxide oxidiert. Man erhielt eine mit NOx verunreinigte und zudem nur
maximal 80proz. Schwefelsäure. Dieses Verfahren erwies sich wegen der Verwendung von Blei als
Kammerauskleidung und der ständigen Emission von NOx als sehr umweltschädigend.
Kontakt- und Doppelkontaktverfahren (1891)
Dagegen arbeiten die modernen Verfahren umweltschonend und sind
häufig sogar Bestandteil von Entschwefelungsanlagen. Man geht ansonsten von Schwefel aus oder von sulfidischen
Erzen wie Pyrit FeS2, die man unter Bildung von SO2 verbrennt. Dieses Oxid wird
an einem Kontakt (heterogener Katalysator) zu Schwefeltrioxid SO3 oxidiert. Letzteres wird
in 80proz. Schwefelsäure geleitet. Es bildet sich rauchende Schwefelsäure (Oleum), die anschließend für
die gewünschten Zwecke verdünnt wird.
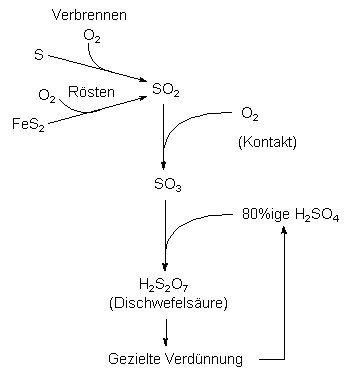
Der Kontakt besteht im Allgemeinen aus Vanadin(V)-oxid V2O5, das mit Kaliumsulfat K2SO4 dotiert ist.
Das Reaktionsgemisch muss hochgereinigt sein. Wegen der hohen Oxidationsenergie müssen die Kontakte ständig gekühlt werden.
Die Emission von nicht umgesetztem SO2 verhindert man durch das Doppelkontaktverfahren, bei dem die Produktgase samt nicht umgesetzter Eduktgase nochmals über einen zweiten Kontakt geleitet werden.
Weitere Texte zum Thema „Schwefel“