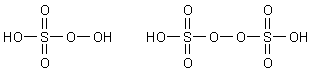
Peroxoschwefelsäuren und Peroxosulfate
Experimente:
Versuch: Einwirkung von Iodid auf Peroxosulfat
Versuch: Peroxosulfat und das Mangansystem
Von großer technischer Bedeutung sind die Peroxosäuren, auch kurz Persäuren
genannt, sowie ihre Salze. Sie tragen alle die Gruppe -O-O-H oder -O-O-. Bekannt sind
die Perborate und Percarbonsäuren als Bleichmittel
in Waschmitteln.
Auch der Schwefel bildet Peroxosäuren: Peroxomonoschwefelsäure H2SO5 (Carosche Säure) und Peroxodischwefelsäure H2S2O8. Sie haben folgende Strukturen:
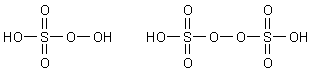
Man erkennt, dass die Peroxomonoschwefelsäure eine einbasige Säure ist.
Beide Perschwefelsäuren können in nennenswertem Umfang nur durch anodische Oxidation an Platinelektroden aus Sulfatlösungen hergestellt werden. Der Grund ist, dass sie rasch wieder unter Rückbildung von Sulfat-Ionen reagieren.
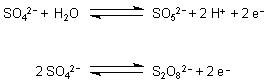
Da die Kalium-Persulfate relativ schlecht löslich sind und so aus dem Gleichgewicht entfernt werden können, geht man bei der Elektrolyse von Kaliumsulfatlösungen aus. Ähnliches gilt auch für die Ammoniumsalze, da die Kalium- und die Ammonium-Ionen gleiche Ionenradien besitzen.
Man muss außerdem mit stark konzentrierten Lösungen arbeiten, da sich in verdünnten Lösungen aufgrund der Konkurrenzreaktion nach der bekannten Sulfat-Katalyse Sauerstoff bildet.
2 SO42- + H2O ———> 2 HSO4- + ½ O2
Persulfate sind starke Oxidationsmittel
Ihr Oxidationspotential E0 liegt bei +2,1 Volt und entspricht etwa dem von
Ozon.
Iodid wird zu Iod oxidiert (-> Versuch).
S2O82- + 2 I- ———> 2 SO42- + I2
Persulfate oxidieren Mn(II)-salze zu Braunstein MnO2 · H2O bzw. MnO(OH)2.
Mn2+ + S2O82- + 3 H2O ———> MnO(OH)2 + 2 SO42- + 4 H+
Beim längeren Erhitzen setzen Persulfate in langsamer Reaktion Wasserstoffperoxid frei.
H2S2O8 + 2 H2O ———> 2 H2SO4 + H2O2
Letzteres wirkt gegenüber starken Oxidationsmitteln reduzierend. Deshalb wird eine Kaliumpermanganatlösung entfärbt (-> Versuch).
2 MnO4- + 5 H2O2 + 6 H+ ———> 2 Mn2+ + 5 O2 + 8 H2O
Praktisch nutzt man Persulfate ähnlich wie Wasserstoffperoxid, z. B. als Bleichmittel. Allerdings kann man durch Erwärmen den Vorgang der Oxidation besser steuern. In der Kunststofftechnologie dienen Peroxosulfate als Polymerisationsstarter.
Weitere Texte zum Thema „Schwefel“