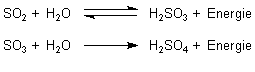
Die wichtigsten Säuren des Schwefels - ein Überblick
Experimente:
Modellversuch zum sauren Regen
Lässt man die beiden Schwefeloxide mit Wasser reagieren, bilden sie als
Nichtmetalloxide in exothermer Reaktion Säuren, die schweflige Säure und die
Schwefelsäure.
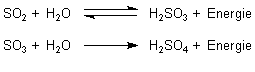
Diese Reaktionen sind Beispiele für die allgemeine Reaktionsgleichung
Nichtmetalloxid + Wasser ———> Säure + Energie
In beiden Fällen liegen wässrige Lösungen vor, und die Säuren dissoziieren und bilden Oxonium-Ionen, färben bestimmte Indikatoren um und leiten den elektrischen Strom.
Die schweflige Säure kommt nur in verdünnter wässriger Lösung vor, während man die Schwefelsäure auch rein ("konzentriert") erhalten kann. Versucht man, schweflige Säure einzudampfen, so entweicht in Umkehrung der Bildungsreaktion Schwefeldioxid.
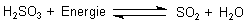
Konzentrierte Schwefelsäure besteht dagegen aus undissoziierten Molekülen mit Formel H2SO4. Sie zeigt deshalb nicht die typischen Eigenschaften von sauren Lösungen. Sie leitet den elektrischen Strom bis auf eine geringe Restleitfähigkeit nicht und reagiert auch nicht mit unedlen Metallen wie Eisen. Aus diesem Grund kann man sie sogar in Eisenkesseln transportieren. Die konzentrierte Schwefelsäure ist stark ätzend und wasseranziehend.
Das alles gilt nicht für die verdünnte Schwefelsäure. Diese reagiert wie die schweflige Säure mit unedlen Metallen wie Zink und Magnesium zu Salzen und Wasserstoff.
H2SO3 + Mg ———> MgSO3 + H2
H2SO4 + Zn ———> ZnSO4 + H2
Beide Säuren sind zweibasig/zweiprotonig und dissoziieren deshalb in zwei Stufen. Die schweflige Säure ist in beiden Fällen eine schwache Säure, d. h. es liegen zwei Dissoziationsgleichgewichte vor.
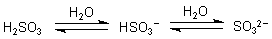
Die pKs-Werte sind pK1 = 1,81 und pK2 = 6,99.
Anders ist es bei der Schwefelsäure: Die erste Dissoziationsstufe weist sie als starke Säure aus, während sich das Hydrogensulfat-Ion als schwache Säure mit einem Dissoziationsgleichgewicht darstellt. Sein pKs-Wert liegt bei 1,89.
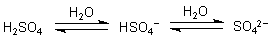
Entsprechend ihrer Protonenzahl bilden die Säuren des Schwefels zwei Reihen von Salzen, die Hydrogensulfite und Hydrogensulfate sowie die Sulfite und Sulfate.
Beide Säuren bilden auch höhere Säuren. Die wichtigsten sind die Dischweflige Säure
H2S2O5 und die Dischwefelsäure
H2S2O7.
Man kann sie formal aus den einfachen Säuren herleiten, indem man das jeweilige Anhydrid addiert.
So lassen sie sich auch technisch herstellen.
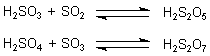
Die Dischwefelsäure ist besonders in der hochkonzentrierten "rauchenden" Schwefelsäure zu finden.
Auch die Disäuren sind zweibasig und bilden zwei Reihen von Salzen. Besonders wichtig ist das Natriumbisulfit, das zur Herstellung von SO2 im Labor dient.
Zum Nachweis von schwefliger Säure verwendet man die bleichende Wirkung gegenüber einigen Farbstoffen wie Fuchsin. Es bildet sich z. B. Fuchsinschweflige Säure, die als Schiffsches Reagenz ein wichtiges Nachweisreagenz für Aldehyde ist.
Wichtig ist der Unterschied der beiden Säuren im Redox-Verhalten. Kennzeichnend für SO2, schweflige Säure und Sulfite ist die Entfärbung von Kaliumpermanganat- und vor allem von Iodlösungen. Schweflige Säure ist somit ein Reduktionsmittel.
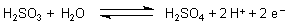
Aus diesem Grund sind auch die Sulfite und Hydrogensulfite nicht beständig, da sie leicht zu Sulfaten oxidiert werden. (Das spielt auch in der Rauchgasreinigung eine wichtige Rolle.) In der Natur kommen deshalb nur die Sulfate als wichtige Mineralien vor.
Umgekehrt ist die Schwefelsäure (allerdings nur in konzentrierter Form) ein Oxidationsmittel, so dass die o. a. Reaktionsgleichung formal ein reversibles Gleichgewichtssystem beschreibt.
Zum Nachweis der Sulfat-Ionen dient die Fällungsreaktion mit Barium-Ionen zu Bariumsulfat:
Ba2+ + SO42- ———> BaSO4
Das muss aber in salzsaurer Lösung geschehen. Denn auch Bariumsulfit und Bariumcarbonat sind schwerlöslich, werden aber in der HCl zersetzt.
Weitere Texte zum Thema „Schwefel“