Prof. Blumes Tipp des Monats Januar 2012 (Tipp-Nr. 175)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Warum bildet sich Ofenruß?
Jetzt ist die Jahreszeit, wo wir über den Ruß nachdenken können: Im Kaminofen brennt das Holz oder die Kohle, Kerzen verbreiten mit ihrem heimeligen Licht Gemütlichkeit. Vielen stellt sich jetzt die Frage: Wieso bildet sich bei heller Flamme und großer Hitze Ruß an den Fenstern eines Kaminofens? Warum rußen Kerzen? Ruß besteht doch aus Kohlenstoff. Der müsste unter den Reaktionsbedingungen doch einfach wegbrennen.

Bild 1: Ruß auf einer Kaminscheibe
(Foto: Blume)
Das können wir mit einem einfachen Experiment untersuchen.
|
Versuch: Rußbildung bei einer Kerzenflamme
|
Auf diese Weise haben wir früher unsere Schutzbrillen zum Betrachten einer Sonnenfinsternis selbst hergestellt.
Viele Leute nehmen an, dass bei der Verbrennung von kohlenstoffhaltigen Materialien wie Kohle, Holz und Papier sowie Kohlenwasserstoffe (z. B. Dieselöl oder Kerzenwachs) nur Wasser und Kohlendioxid entstehen. In letzter Konsequenz stimmt das auch - wie z. B. bei den Kohlenwasserstoffen:
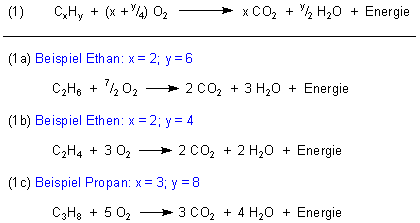
Jedoch ist es von den Brennmaterialien bis zu H2O und CO2 ein langer chemischer Weg, der alles andere als direkt verläuft. Zum Beispiel muss sich im Verlauf dieser Reaktionskette irgendwie Kohlenstoff bilden.
In diesem Zusammenhang sei daran erinnert, dass die gängigen Brennmaterialien wie Holz und Papier sowie Kohle letztlich Derivate von Kohlenwasserstoffen sind, so dass wir die Diskussion anhand der überschaubareren Reaktionsabläufe dieser Substanzgruppe führen können.
Zunächst bilden sich hitzebedingt Gase und Radikale wie z. B.
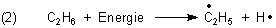
Die H-Atome können auch direkt von Sauerstoffmolekülen, die bekanntlich selbst Radikale sind, übernommen werden. Natürlich kann der Sauerstoff auch mit den Kohlenwasserstoffen direkt reagieren - wobei die Bildung von CO2 vorbereitet wird. Auf jeden Fall entstehen Hydroxylradikale HO· oder auch Hydroperoxid-Radikale HOO· und natürlich auch H2O-Moleküle.
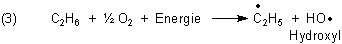
Es gibt unglaublich viele weitere Reaktionsmöglichkeiten, an denen sogar noch Ionen beteiligt sind. Letztlich kann es zur Abspaltung aller H-Atome kommen.
Folge dieses „Strippens“ der Kohlenwasserstoffmoleküle ist, dass es freie C-Atome geben muss. Diese fliegen sehr schnell in der heißen Gasphase herum und suchen sich einen Bindungspartner. Das können auch andere C-Atome sein.
Wenn die C-Atome auf kühlere Flächen treffen, verlieren sie Energie und lagern sich zu Kohlenstoffatom-Aggregaten zusammen. Man spricht vom „Abschrecken“ der Flamme. Dabei bildet sich das energetisch besonders günstige Graphitgitter - das ist der Ruß.
Auf gleiche Weise ist die Rußentwicklung einer „blakenden“ Kerzenflamme zu erklären. Der Unterschied ist nur, dass hier zum Abschrecken der heißen Flammengase keine kalte Oberfläche notwendig ist. Hier übernimmt die kalte Umgebungsluft diese Rolle.
Was wir besprochen haben, gilt auch für die als umweltfreundlich geltenden Dieselmotoren. Aus deren Auspuff quillt bekanntlich reichlich Ruß - eine der Hauptquellen für den berüchtigten Feinstaub.
Bei präziser technischer Steuerung (zum Beispiel hinsichtlich der Temperatur, dem Druck oder Anwesenheit bestimmter Fremdsubstanzen) kann man beim Verbrennen von Kohlenwasserstoffen verschiedene Modifikationen des Kohlenstoffs erhalten. So lassen sich statt eines aus Graphit bestehenden Rußbelags sogar reine Diamantenüberzüge herstellen - oder auch Fullerene und Nanotubes.
Zur Flammenfärbung muss man auch noch etwas sagen
Es fällt auf, dass die Flamme von brennendem Holz gelb erscheint. Das ist immer der Fall, wenn Ruß erhitzt wird - das ist also
auch in Indiz dafür, dass sich freier Kohlenstoff in den Flammen befindet. Je mehr Sauerstoff zugegen ist, desto weniger Kohlenstoff
kann sich halten. Schüler kennen das vom Bunsenbrenner: Durch Erhöhen der Luftzufuhr wird die Flamme „entleuchtet“.
Dass die Asche purpurn leuchtet, liegt an den Kaliumverbindungen wie Pottasche, die beim Verbrennen von Holz freigesetzt werden.

Bild 2: Ofenflamme
(Foto: Blume)
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 20. Januar 2013, Dagmar Wiechoczek