Prof. Blumes Tipp des Monats Februar 2011 (Tipp-Nr. 164)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Die Leuchtprobe auf Zinn
Zinn ist ein bemerkenswertes Metall. Es gehört zu den Tetrelen, also zu den Elementen der vierten Hauptgruppe („Kohlenstoffgruppe“). Wir haben auf unserem Server schon einige Themen um das Zinn behandelt, zum Beispiel:
Warum Napoleon das Zinn verfluchte
Korrosion anderer Metalle: Beispiel Zinn
Wenn der schützende Überzug verletzt ist
Zum Rosten einer Weißblechdose
Gefragt wird weiter immer wieder nach genaueren Informationen zu einem speziellen, schönen Versuch, den man im Schullabor wohl noch einige Zeit machen darf. Es geht um eine Nachweisreaktion für Zinn und seine Verbindungen.
|
Versuch: Leuchtprobe auf Zinn
Man stellt in einem kleinen Becherglas eine etwa 5-10%ige Lösung von Zinn(II)-chlorid (Xi) in konzentrierter Salzsäure (C) her. Man kann auch metallisches Zinn in Salzsäure zersetzen. Oder man zersetzt Zinn(IV)-oxid mit warmer Salzsäure. Dann füllt man ein sauberes, auch von außen fettfreies Reagenzglas mit kaltem Wasser. Man entzündet einen Bunsenbrenner und stellt die Flamme auf „nicht leuchtend“. In die Zinnsalz-Lösung gibt man einige Zinkgranalien. Es entwickelt sich eine Menge Wasserstoff (F+). Anschließend benetzt man die Außenseite des gekühlten Reagenzglases mit der Zinnsalz-Lösung und hält es kurz in die Flamme. Man erkennt einen leuchtend blauen Flammensaum. Den Versuch kann man mehrmals wiederholen. Allerdings muss man ab und zu das Wasser im Reagenzglas erneuern, da es für den Versuch absolut kalt sein muss. Ein Stückchen Eis hilft dabei. |

Leuchtprobe zum qualitativen Nachweis von Zinn
(Foto: Daggi)
Wie kommt es zur Lumineszenz?
Zur Erklärung gehen wir vom Zinn(IV)-oxid aus.
Beim Zersetzen („Lösen“) in warmer Salzsäure geht dieses in Zinn(IV)-chlorid über:
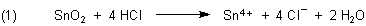
(Wenn wir Zinn nehmen, bildet sich Zinn(II)-chlorid.)
Geben wir Zinkgranalien in diese Lösung, so bildet sich Wasserstoff. Dieser liegt im Moment des Entstehens atomar vor („in statu nascendi“, lat. für „im Zustand der Geburt“).
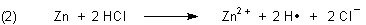
Manche der nur in Spuren vorkommenden, frei vagabundierenden H-Atome (man spricht auch von Radikalen) reagieren, bevor sie wie die meisten anderen zu H2-Molekülen dimerisieren, mit anderen Stoffen, auf die sie ihr einzelnes Elektron übertragen. Solche Wasserstoffatome sind deshalb besonders starke Reduktionsmittel. Sie vermögen beispielsweise Zinn(IV) zu Zinn(II) zu reduzieren.
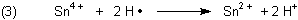
Manche meinen nun, dass, wenn man dieses Zinn(II) in die Flamme bringt, es wieder zu Zinn(IV) oxidiert wird. Die Oxidationsenergie manifestiere sich als Lumineszenz. Das ist leider nicht der Fall, wie man anhand eines Versuchs mit reinem Zinn(II)-Salzlösungen (ohne Zinkgranalie!) zeigen kann.
Die Ursache für den blauen Flammensaum ist eine andere: Der radikalische Wasserstoff reduziert das Zinn(II) durchaus auch weiter zu Zinn mit der Oxidationszahl (-IV):
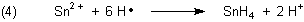
Dabei entsteht gasförmiger Zinnwasserstoff, den man auch (Mono-)Stannan nennt. (Er ist sozusagen das Gruppenhomologe zum Methan.) Stannan ist zwar in großer Konzentration giftig; das kann man aber unter den Bedingungen unseres Versuchs getrost vernachlässigen. Das Gas, das bei unserem Experiment entsteht, besteht vor allem aus Wasserstoff, in denen das Stannan nur in minimalen Spuren enthalten ist. Die reichen aber aus, um uns mit dem schönen Leuchten zu verzaubern: Denn Stannan brennt, und zwar mit blauer Flamme!
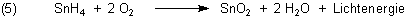
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 23. Juni 2011, Dagmar Wiechoczek