Prof. Blumes Tipp des Monats Februar 2014 (Tipp-Nr. 200)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Säuren und Metalle
Ein Schüler bat mich, ihm bei der folgenden Hausaufgabe zu helfen:
|
“Konzentrierte Salpetersäure dient als "Scheidewasser" zur Trennung von Silber und Gold. Silber löst sie unter Bildung von u. a. Stickstoffmonoxid und Silber(I)-oxid auf und bei weiterer Zugabe unter Bildung von Silber(I)-nitrat. Formuliere die Redoxgleichung.“ |
Bei der Fragestellung ist Folgendes sicherlich nicht richtig: Es wird der Anschein vermittelt, dass sich zunächst Silberoxid bildet. Bei dem handelt es sich um einen schwarzbraunen Festkörper, den dabei wohl noch niemand gesehen hat... Führen wir doch einmal den Versuch selbst durch:
|
Versuch 1: Silber und Salpetersäure
|
Das Silber ist die ganze Zeit über metall-farbig geblieben; einen dunklen Überzug haben wir nicht erkennen können. Vielmehr überführt die Salpetersäure als Oxidationsmittel Silbermetall nur in Silber-Ionen, in dem es dem Metall Elektronen entzieht. Dabei wird die Salpetersäure reduziert; als Reaktionsprodukt entsteht Stickstoffmonoxid NO. Genau genommen wurde der der Salpetersäure zugrunde liegende Stickstoff reduziert:
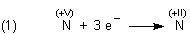
Zum Aufstellen der Redoxgleichung trennt man zunächst Oxidation und Reduktion:
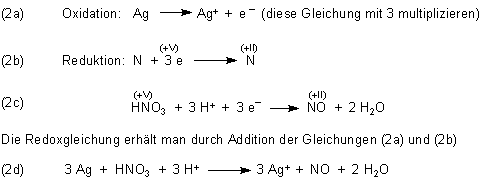
Wenn man beim Experiment genau hinsieht, erkennt man, dass das Silberstück in der konzentrierten Salpetersäure mit einem farblosen Gas überzogen wird. Das ist das primäre Reaktionsprodukt Stickstoffmonoxid NO, das farblos ist. Wenn das Gas aus der Flüssigkeit austritt, wird es in einer Folgereaktion durch Luftsauerstoff zu braunem Stickstoffdioxid oxidiert:
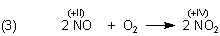
Dieses Experiment sollten wir nutzen, um etwas über die Säuren und deren Reaktionen nachzudenken. Dazu kann man sich eine Menge von interessanten Experimenten ausdenken, die z. B. in Gruppenarbeit mit unterschiedlichen Aufgaben durchgeführt werden sollten.
In der Chemiegeschichte spielten Reaktionen zwischen Säuren und Metallen eine wichtige Rolle
Fast jeder kennt wohl die Begriffe Scheidewasser und Königswasser. Zur Benennung als „Wässer“ muss
man wissen, dass alles, was flüssig war, im Rahmen der Vier-Elemente-Lehre zum vermeintlichen Element Wasser gezählt wurde.
Salzsäure löst nur unedle Metalle wie Eisen oder Zink auf, nicht jedoch das Kupfer. Salpetersäure löst zwar Kupfer und Silber auf, aber nicht Gold. Diese Säure diente also zum Unterscheiden beider Metalle (Scheidewasser). „Scheidekunst“ ist auch heute noch im flämischen Sprachgebrauch das Wort für Chemie.
Ein Gemisch aus 1 Volumenteil konzentrierter Salpetersäure mit 3 Teilen konzentrierter Salzsäure ist sogar so aggressiv, dass es auch das Königlichste der Metalle, das Gold, auflöst (Königswasser oder aqua regia, lat. regia, königlich).
Man kann mit bestimmten Säuren auch Mischungen von Metallen, also Legierungen, mit Hilfe bestimmter Säuren trennen oder ihre
Bestandteile erkennen:
- Salzsäure HCl trennt manche Messingarten (Cu/Zn), indem es nur Zink auflöst, wobei Kupfer zurückbleibt.
- Salpetersäure HNO3 sowie auch heiße Schwefelsäure trennen Legierungen wie Cu/Au und Ag/Au, indem sie Kupfer
und Silber herauslösen, wobei Gold zurückbleibt.
- Königswasser HNO3/3 HCl zersetzt Au und die Platinmetalle.
(Platin war früher weniger bekannt; wenn ja, erachtete man es als wertlos (daher der Name vom spanischen platina, Silberchen). Man fürchtete es sogar wegen der drohenden Fälschung von Silber und Gold durch Zusatz von Platinmetallen. Deshalb haben die Spanier beim Ausplündern der peruanischen Bodenschätze anfallendes Platin penibel abgetrennt, gesammelt und in Barrenform samt Schiffen vor Südamerika im Meer versenkt. Diese Wracks aufzuspüren gehört heute zu den schönsten Träumen der professionellen Schatzsucher…)
Was die Säuren unterscheidet
Es gibt offenbar Säuren, die auch edle Metalle zersetzen („auflösen“). Umgekehrt gibt es Metalle, die sich in manchen Säuren, die wie die
konzentrierte Salzsäure oder kalte, konzentrierte Schwefelsäure eigentlich als sehr aggressiv gelten, nicht auflösen lassen.
Man unterscheidet in diesem Zusammenhang zwei Säureklassen:
"Normale" Säuren wirken nur über ihre Protonen.
Beispiele sind Salzsäure, Phosphorsäure, kalte konzentrierte Schwefelsäure, verdünnte Salpetersäure.
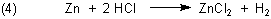
Sie zersetzen nur unedle Metalle.
Oxidative Säuren wirken dagegen über ihre Anionen.
Die Anionen oxidieren das Metall und werden dabei selbst reduziert. Ein bekanntes Beispiel ist neben der schon besprochenen Salpetersäure
die heiße, konzentrierte Schwefelsäure.
|
Versuch 2: Kupfer und Schwefelsäure
|
Die Reaktionsgleichung lautet:
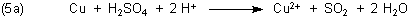
Es läuft ein Redoxprozess zwischen den Anionen als Oxidationsmittel und den Metallen als Reduktionsmittel ab.
Die Nachweisreaktion von Schwefeldioxid mit Iod ist ebenfalls eine Redoxreaktion.
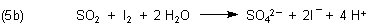
Die Säure-Protonen spielen immer mit
Das trifft für normale Säuren wie für die oxidativen Säuren zu. Aber der Part, den die Protonen jeweils spielen,
ist unterschiedlich:
Bei der Reaktion zwischen normalen Säuren und unedlen Metallen um einen Redoxprozess, der nur die Protonen betrifft: Sie oxidieren das Metall, indem sie ihm Elektronen entziehen, wobei sie selbst zu Wasserstoff reduziert werden.
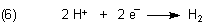
Die Anionen normaler Säuren bleiben bei diesen Reaktionen unverändert.
Aber auch bei den oxidativen Säuren spielen dissoziable Protonen eine gewichtige Rolle, allerdings ohne ihre Oxidationsstufe (+I) zu ändern. Sie wirken bei der Redoxreaktion der Anionen nur indirekt mit, indem sie den Sauerstoff ohne Änderung seiner Oxidationszahl (-II) aus entsprechenden Anionen unter Bildung von Wasser abfangen. Beispiele sind die schon besprochenen Reaktionen der Nitrate (Gl. 2c) sowie der Sulfate (Gl. 5).
Zur Oxidation der Metalle durch oxidierende Säuren
Halten wir fest: Edlere Metalle wie Cu, Hg, Ag, Au und Pt können durch Protonen H+ nicht oxidiert werden.
Zur Salzbildung müssen die Metalle diese aber aus der Säure verdrängen. Deshalb muss man sie zuvor auf andere Art und
Weise oxidieren.
Beispielsweise kann man Kupfer nicht in Salzsäure lösen. Wie kann man dann überhaupt Kupferchlorid herstellen? Man muss das Kupfer zuvor oxidieren - z. B. durch Erhitzen in Gegenwart von Sauerstoff.
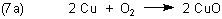
Das entstehende Kupfer(II)-oxid können normale Säuren leicht zersetzen.
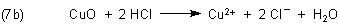
Das eben Gesagte darf aber nicht dazu verführen, dass man wie in der obigen Aufgabe sagt, dass oxidative Säuren edle Metalle wie das Silber erst in ihr Oxid und dann im Überschuss in ihre Salze verwandeln. Man muss betonen, dass die Anionen direkt an die Metalloberfläche andocken, dort die Elektronen abziehen und auf diese Weise dafür sorgen, dass die Metall-Ionen ohne Umweg über eine Oxidbildung direkt in Lösung gehen.
Es sei fairerweise darauf hingewiesen, dass hierüber durchaus gestritten wird. Unterstützer der Theorie der primären Oxidbildung verweisen darauf, dass unedle Metalle wie Eisen oder Aluminium in konzentrierter Salpetersäure und in wasserfreier Schwefelsäure durchaus stabil sind. Das liegt an der Passivierung, also an der Bildung von fest haftenden oxidischen Überzügen. Gegen eine primäre Oxidbildung spricht zumindest bei edlen Metallen, dass sie als Redoxkatalysatoren wirken, die auch in anderen Fällen für den schnellen Übergang von Elektronen sorgen. Deshalb setzt man sie z. B. als Redox-Elektroden in der Elektrochemie ein. Hier würde die Bildung eines festen Oxidüberzugs Messungen stark stören.
Vielleicht können energetische Überlegungen für Klarheit sorgen. Voraussetzung für eine Passivierung ist eine vergleichsweise hohe Bildungsenthalpie der Oxide, verbunden mit einer stofflich starken Fixierung auf der Metalloberfläche.
| Oxid | Bildungsenthalpie (kJ/mol) |
| Al2O3 | -1675,7 |
| Fe2O3 | -824,2 |
| CuO | -157,3 |
| Ag2O | -31 |
| Au2O3 | -81 |
| PtO2 | ? (keine Angaben) |
Je edler die Metalle sind, desto kleiner ist die Bildungsenthalpie ihrer Oxide. Deshalb kommt es nur zu einem Elektronentransfer
von Metall zum Anion. Dieser wird begleitet von einem simultanen Protonenangriff auf das nunmehr mit negativen elektrischen Ladungen
„überfüllten“ Anion. Das hat die Abspaltung eines O2--Ions in Form von Wasser zur Folge. Dadurch
wird letztlich das Zentralatom des Anions (wie N beim Nitrat oder S beim Sulfat) reduziert.
Hinter der Chemie der Säuren stecken elektrochemische Prozesse
Normale Säuren reagieren nur mit unedleren Metallen, also um solche, deren elektrochemisches Redoxpotential unter dem der
Wasserstoff-Ionen H+ liegt, d. h. E0 < 0 Volt. Metalle, deren Redoxpotential größer als 0 Volt ist (E0
> 0 Volt), können durch H+ nicht oxidiert werden.
Ob und welche oxidative Säuren in der Lage sind, edlere Metalle wie Kupfer, Quecksilber, Silber, Gold oder Platin zu zersetzen, ist demnach eine Frage der Redoxpotentiale der Säuren bzw. ihrer Anionen einerseits und Metallen andererseits. Zur Zersetzung eines Metalls muss das oxidierende Anion ein positiveres Redoxpotential aufweisen als das Metall. Man kann das in einer Art Spannungsreihe zeigen:

Die Werte der Redoxpotentiale können noch durch Variation der Reaktionsbedingungen wie Konzentrationen, pH-Werte und Temperatur beeinflusst werden.
Was genau ist Königswasser?
Wie schon gesagt, handelt es sich um eine Mischung von 1 Volumenteil konzentrierter Salpetersäure und 3 Volumenteilen konzentrierter Salzsäure.
|
Versuch 3: Demonstration von Königswasser
|
Nach dem Mischen läuft in der Lösung folgende Reaktion ab:
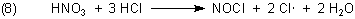
Neben Nitrosylchlorid NOCl entstehen zunächst Chloratome, also Radikale. Chloratome sind äußerst reaktiv; sie haben folglich ein besonders hohes Redoxpotential. Sie können deshalb auch Gold zersetzen, was durch die Bildung von Goldkomplexen (wie z. B. Tetrachloroaurat) noch gefördert wird.
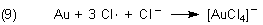
Analoges gilt für die Platinmetalle.
Früher stellte man Königswasser her, indem man in konzentrierter Salpetersäure Salmiaksalz, also Ammoniumchlorid NH4Cl, löste. Aus letzterem bilden sich unter der Einwirkung von HNO3 oxidativ Nitrosylchlorid und Chlorradikale.
In diesem Zusammenhang muss auch das Chlorwasser angesprochen werden
Diese Mischung reagiert sauer. Sie stellt die wohl aggressivste Säure dar, was die Wirkung auf Metalle angeht. Ihre verheerende Wirkung
z. B. auf Platin stellt man im Schullabor leicht fest, wenn man versucht, mit Platinelektroden Natriumchloridlösungen zu elektrolysieren.
Vergisst man nämlich nach Ende des Versuches, die Elektroden schnell aus der Lösung herauszunehmen und zu reinigen, findet man am nächsten
Morgen statt der Metall-Elektroden eine schön gelbe Lösung, deren Farbe auf der Bildung von Hexachloroplatinat-Komplexen beruht.
Im Chlorwasser findet sich eine Vielzahl von Verbindungen des Chlors, deren Redoxpotential sehr hoch ist. Hinzu kommt die Feisetzung von Chlorradikalen sowie von Sauerstoffatomen. Das alles ist Grund für die starke Reaktivität von Chlorwasser.
Auch Wasserstoffsäuren können sehr aggressiv wirken
Denn der Wasserstoff, der bei der Entladung der Protonen entsteht, ist zunächst radikalisch. Er befindet sich poetisch-alchemistisch
formuliert „in statu nascendi“, das heißt im Zustand des Gebärens. So kann man mit Salzsäure Pyrit
FeS2 erst zersetzen, indem man einige Zinkgranalien hinzufügt:
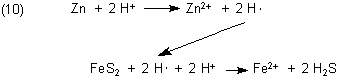
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 27. Februar 2014, Dagmar Wiechoczek