Prof. Blumes Tipp des Monats März 2014 (Tipp-Nr. 201)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Wie man Taubenmist purpurn färben kann
Jedem ist es wohl schon passiert: Eine Stadttaube fliegt vorbei, und „Klacks!“ hat man einen weißen Streifen auf der Mütze oder auf der Jacke. Unappetitlich, aber chemisch durchaus interessant. Denn die weiße Substanz ist Harnsäure.

Bild 1: Vogelkot. Die weiße Masse ist Harnsäure
(Foto: Blume)
Von der Harnsäure gibt es zwei Strukturen.
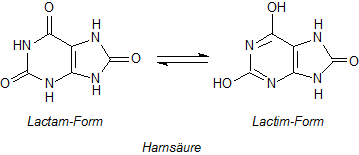
Diese Strukturen der Harnsäure zeigen isomere Grenzzustände einer Reihe von chemischen Gleichgewichten. Die Wahrheit liegt irgendwo dazwischen.
Die Form des zugrunde liegenden Gleichgewichts nennt man Lactim/Lactam-Tautomerie. (Lactame sind cyclische Säureamide.)
Dies ist ein Sonderfall der Keto/Enol-Tautomerie. Das Tautomerie-Gleichgewicht betrifft vor allem die Amide des
sechsgliedrigen Pyrimidinrings. Ursache ist wohl, dass sich bei der Lactimbildung ein planares, aromatisches Elektronensystem entwickeln kann.
Die dritte potentielle Hydroxylgruppe am Imidazolring spielt bei der Tautomerie offensichtlich keine besondere Rolle. Trotzdem findet man oft
Darstellungen, bei denen alle Lactame in Lactime überführt sind.
Es handelt sich also keinesfalls um ein Redox-Gleichgewicht, sondern nur um die innermolekulare Verschiebung von Wasserstoffatomen.
Warum reagiert die Harnsäure sauer?
Nur die beiden Hydroxylgruppen im Pyrimidinring geben in Gegenwart einer Base wie Wasser ihre Protonen ab. Das liegt an den benachbarten Doppelbindungen und
aufgrund der stärker elektronegativen Stickstoffatome, was zu einem Abzug von Elektronen aus den Bindungen zwischen H und O führt.
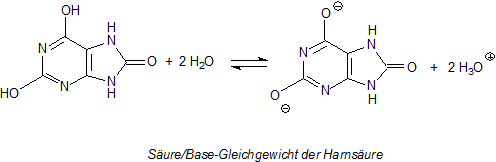
Die Harnsäure bildet nur zwei Reihen von Salzen, die sauren Hydrogenurate und die neutralen Urate. Die Gleichgewichtslage hängt vom pH-Wert der
Umgebung ab. Der erste pKs-Wert liegt bei pH = 5,82, der zweite bei pH ~ 9. Zu einer Abspaltung des dritten H-Atoms kommt es nicht - wohl
auch wegen der zu großen Anhäufung von negativen Ladungen.
Woher die Harnsäure stammt
Um zu verstehen, welche Rolle Harnsäure in der physiologischen Chemie spielt, muss man wissen, dass es sich um ein Abkömmling des Purins handelt. Der
chemische Name ist Purin-3,6,8-trion. Biologisch bedeutsame Purine kennen wir als Basen der Nucleinsäuren bzw. aus dem
Biochemischen Energiestoffwechsel, bei denen Verbindungen wie ATP und GTP eine wichtige Rolle spielen.
Die Harnsäure ist ein Abbauprodukt der Purinbasen Adenin und Guanin.
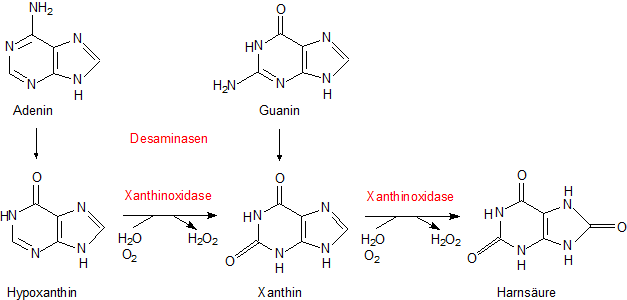
Bemerkenswert ist das Enzym Xanthinoxidase, das hier zweifach wirkt. Es arbeitet mit dem Coenzym Flavin als Cofaktor.
Harnsäure ist finales Ausscheidungsprodukt bei Reptilien und Vögeln (die wegen der Dinosaurier als gemeinsame Vorfahren verwandt sind). Bekannt ist fossiler Vogelkot unter der Bezeichnung Guano. Da dieser Vogelkot im Allgemeinen sehr lange in der freien Natur lagert, ist die Harnsäure teilweise zu Nitrat oxidiert - unter anderem durch mikrobiologische Mitwirkung.
Die meisten Säugetiere bauen Harnsäure weiter ab. Sie verfügen über das Enzym Uricase, das Harnsäure zu einer gut löslichen und deshalb gut ausscheidbaren Verbindung namens Allantoin abbaut. Den Primaten fehlt die Uricase.
Zuviel Harnsäure ist schädlich
Deshalb ist bei den Primaten die Konzentration der Harnsäure im Blut recht hoch. Das liegt unter anderem auch daran, dass die
schädliche Harnsäure in der Niere nicht umgehend ausgeschieden wird, sondern merkwürdigerweise dazu noch über ein Anionenaustauscher-System
der Niere umständlich resorbiert wird.
Das hat Folgen: Die Harnsäure ist schlecht löslich. Das gilt auch für ihre sauren Salze wie Monoammonium- sowie als Mononatriumurat. Deswegen kristallisieren Harnsäure und Hydrogenurate leicht aus. Dies geschieht vor allem in den Gelenken mit der Folge von Gichtknoten in den Gelenken oder Trübungen in der Augenlinse (Star). In der Niere ist Harnsäure an der Bildung der so genannten Organischen Steine beteiligt.
Lithiumurate sind dagegen löslich. Deshalb kann man die Harnsäure durch hohe Lithiumkonzentrationen ausschwemmen. Darauf soll dem Vernehmen nach die Wirkung der die Gichtsymptome lindernden Heilwässer von Bad Ems beruhen.
Hat die Ernährung Einfluss auf die Gichtentstehung?
Ja. Besonders purinhaltige Speisen sind zu meiden. Dazu gehören neben Fleisch aber auch als gesund geltende pflanzliche
Lebensmittel wie die Sojabohne. Manche Autoren zählen deshalb Purine zu den biogenen Giftstoffen und entsprechende Pflanzen zu den
Giftpflanzen.
Nicht harnsäurebildend sind die methylierten Purine Coffein und „Teein“, die in Kaffee und Tee enthalten sind.
Versuche zur Chemie der Harnsäure
|
Versuch 1: Vogelkot reagiert sauer
|
|
Versuch 2: Löslichkeit von Harnsäure
|
Die schlechte Löslichkeit hängt damit zusammen, dass die Moleküle mehr oder weniger planar sind und untereinander hervorragend Wasserstoffbrücken ausbilden können.
|
Versuch 3: Herstellen einer Harnsäurelösung
|
Wenn man die Ammoniumsalze der Harnsäure herstellen will, muss man beachten, dass es zwei Reihen von Salzen gibt. Das Monoammoniumsalz ist schwerlöslich, während das Diammoniumsalz leichter löslich ist. Wenn man zur Harnsäurelösung Ammoniak hinzu gibt, unterbleibt deshalb die Niederschlagsbildung weitgehend, da der pH-Wert der Mischung größer als der pKs2-Wert 9 der Harnsäure ist. Das heißt, dass sich dann das Diammoniumsalz bildet. Will man nur das Monoammoniumsalz herstellen, muss man die schwach saure Lösung von Ammoniumchlorid zur Harnsäure hinzugeben.
|
Versuch 4: Herstellen von schwerlöslichem Monoammoniumurat
|
Murexidprobe auf Harnsäure
Die wohl bekannteste und zugleich schönste Nachweisreaktion ist die Murexidprobe, der wir einen eigenen Abschnitt widmen.
|
Versuch 5: Murexidprobe auf Harnsäure
|

Bild 2: Murexidprobe
(Foto: Daggi)
Die purpurfarbene Substanz heißt Murexid. Das Wort stammt vom wissenschaftlichen Namen für die Purpurschnecke
(Murex trunculus). Die Substanz hat aber nichts mit dem Farbstoff Purpur
zu tun. Letzterer ist ein Abkömmling des Indigos.
Murexid ist das Ammoniumsalz der Purpursäure.
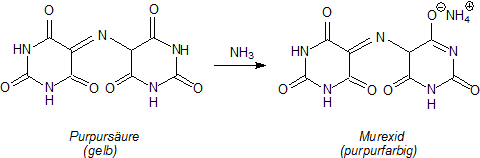
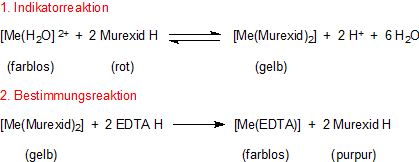
Murexid ist nicht nur für den Nachweis von Harnsäure wichtig, sondern auch als Bildner von Chelat-Komplexen,
der in der Komplexometrie z. B. bei der Ermittlung der Wasserhärte als Indikator Verwendung
findet. Das liegt daran, dass der Indikator-Komplex anders gefärbt ist (nämlich gelb) als der Ligand (purpur). Unser Chelatkomplex
umfasst das Zentral-Ion und zwei Murexid-Liganden.
Wir erklären das Verfahren genauer am Beispiel von Eriochromschwarz T.
Rüdiger Blume
Literatur
[1] Experimente nach: Physiologisch-Chemisches Praktikum. Manuskript des Physiologisch-Chemischen Instituts der Universität
Tübingen 1964.
[2] W. Kratzert, R. Peichert: Farbstoffe. Quelle und Meyer. Heidelberg 1981.
[3] E. Buddecke: Grundriss der Biochemie. Walter de Gruyter-Lehrbuch. Berlin 1971.
[4] H. Beyer: Lehrbuch der Organischen Chemie, S. Hirzel Verlag, Leipzig (neueste Auflage).
[5] E. Teuscher, U. Lindequist: Biogene Gifte; Wissenschaftliche Verlagsgesellschaft, 3. Auflage, Stuttgart 2010.
[6] W. Pschyrembel: Klinisches Wörterbuch, de Gruyter, Berlin (neueste Auflage).
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 27. Februar 2014, Dagmar Wiechoczek