Prof. Blumes Tipp des Monats Oktober 2012 (Tipp-Nr. 184)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Chemie im Widerstand
Die folgende Anfrage flatterte in mein E-Mail-Körbchen:
|
Kürzlich erfuhr ich während einer Stadtführung etwas über Anna Beyer, die Mitglied einer Widerstandsgruppe gegen den Nationalsozialismus gewesen ist. Zu dem, was ich über sie und die Widerstandsgruppe erfahren habe, zitiere ich einen Wikipedia-Eintrag: "... Zur Verbreitung anti-nationalsozialistischer Aufrufe nutzte Beyer einen speziell angefertigten Koffer, mit dem sie abends über den Eisernen Steg in Frankfurt ging: Der Kofferboden war so präpariert, dass beim Abstellen des Koffers durch unten angebrachte Schwämme, die mit einer speziellen Tinte getränkt waren, die Parole „Nieder mit Hitler“ auf den Straßenasphalt gedruckt wurde - ähnlich wie bei einem Stencil Graffiti. Am nächsten Tag wurde durch das Sonnenlicht die Parole jeweils sichtbar gemacht ..." Ich schreibe Ihnen diese E-Mail, weil während der Führung die Frage aufkam, aus was die oben erwähnte "spezielle Tinte" bestanden haben könnte, und hoffe, dass Sie eine Idee bezüglich der möglichen Zusammensetzung haben. Über eine Antwort würde ich mich sehr freuen! PS: Vielen Dank für Ihr tolles Internetangebot, das ich schon länger interessiert verfolge! |
Meine Antwort:
Die Brücke kenne ich, vor allem wegen des griechischen, homerischen Sinnspruchs
(„Segelnd auf weindunklem Meer hin zu Menschen anderer Sprache“).

Bild 1: Eiserner Steg über den Main in Frankfurt
(Foto: Blume)
Es handelt sich bei der fraglichen Mischung sicherlich um eine Geheimtinte. Deren Basis ist
offensichtlich Hexacyanoferrat(III), das durch Oxalat oder Citrat unter Lichteinwirkung
zu Hexacyanoferrat(II) reduziert wird. Letzteres reagiert mit hinzugefügten Fe(III)-salzen zu Berliner Blau.
Den Versuch können Sie selbst ausprobieren:
|
Versuch 1: Geheimtinte mit Eisenverbindungen
(Rezept abgewandelt nach Roesky-Möckel [1]) Die Lösungen werden in einem nicht zu hellen Raum zusammengegeben. Es entsteht eine gelbe Mischung. Wir verteilen den Ansatz auf zwei Kristallisierschalen. Die eine Probe stellen wir ins Dunkle. Die andere setzen wir einer starken Lichtquelle aus (Sonnenlicht, Halogenlampe, Overhead-Projektor). Ergebnis (-> Bild 2): Die Farbe der Probe im Dunkeln bleibt unverändert.
Bild 2: Versuchsergebnis zur Geheimtinte.
Hinweis: Wir haben die Lösung auch auf Papier gegeben. Offenbar reagiert die Mischung mit Inhaltsstoffen der von uns benutzten Papiersorten auch ohne Belichtung. Auf einem Wischtuch (Zewa ®) verfärbte sich die Lösung augenblicklich blau. Weißes Schreibpapier wurde braun. Mit Filterpapier sollte es aber gehen. Probieren Sie es mal aus! Außerdem ist es eine Frage der Stärke der Lichtquelle. Je stärker die Lichtquelle ist, desto schöner wird das Blau des Papiers. |
Zu den chemischen Reaktionen
Hexacyanoferrat(III) wird zu Hexacyanoferrat(II) reduziert, Oxalsäure dabei zu CO2
oxidiert.
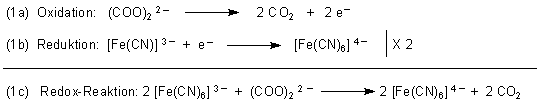
(Man sollte deshalb eigentlich auch Gasblasen sehen - aber das ist negativ. Wahrscheinlich sind die Konzentrationen zu gering und die Lösungen zu wenig sauer, so dass sich das CO2 nur im Wasser löst.)
Parallel dazu folgt die Bildung von löslichem Berliner Blau.
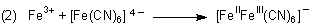
|
Lieber Herr Professor Blume,
|
Wenn Sie den Schwammtrick nachmachen wollen, so empfiehlt es sich, die Lösungen doppelt so konzentriert herzustellen.
Von dem Versuch gibt es viele Varianten
Ein in der Chemiedidaktik (so auch in Bielefeld) sowie in der Wunderstunden-Chemie verankertes Rezept arbeitet mit Ammoniumeisen(III)-citrat.
Hier ist eine gängige Versuchsvorschrift:
|
Versuch 2: Geheimtinte - Rezept 2
Anschließend werden beide Lösungen zusammen in eine Kristallisierschale gegeben. Man legt ein Filterpapier hinein, holt es nach dem Vollsaugen
heraus und lässt es abtropfen. Man trocknet mit einem Fön®.
Ergebnis: Nach ca. 5 min Belichtung ist das Filterpapier tief blau geworden (-> Bild 3).
|

Bild 3: Versuchsvariante 2
(Fotos: Daggi)
Noch ein Hinweis: Es wird oft gefragt, welche Zusammensetzung Ammoniumeisen(III)-citrat eigentlich hat. Im Merck®-Katalog steht
dazu C6H8O7 • x Fe • x NH3. Die Verbindung heißt deshalb auch Citronensäure Ammonium-Eisen(III)-salz.
Man sie mit verschiedenen Eisengehalten erwerben.
Bei diesem Versuch denkt man automatisch an die Chemie des fotografischen Prozesses. Auf einer besonderen Webseite vergleichen wir die Chemie der Silber-Fotos mit der von Fotos auf der Basis von Berliner Blau.
Literatur
[1] H. W. Roesky, K. Möckel: Chemische Kabinettstücke. VCH. Weinheim 1994.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 01. Oktober 2012, Dagmar Wiechoczek
