Prof. Blumes Tipp des Monats November 2009 (Tipp-Nr. 149)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Der Chemische Garten

Bild 1: Ein Stück unseres sommerlichen Gartens
(Foto: Blume)
Die sommerliche und herbstliche Blumenpracht ist zu Ende. Da wird es Zeit, sich nach Ersatz
umzusehen. Wie wäre es mit einem chemischen Garten? Der hat den Vorteil, dass man ihn sich
selbst züchten kann. Außerdem braucht man ihn auch nicht zu gießen. Und dazu lernt man wieder
eine Menge an Chemie.
Sie benötigen neben verdünnter Wasserglaslösung möglichst große Kristalle (aber keine selbstgezüchteten Kristallriesen!) von den folgenden Salzen. Man nimmt natürlich die handelsüblichen Formen (also die entsprechenden Hydrate).
| Salze | Gefahrensymbole | Farbe der "Pflanze" |
| Kupfer(II)-sulfat oder
Kupfer(II)-chlorid |
Xn N | hellblaugrün |
| Calciumchlorid | Xi | weiß |
| Kalium-Aluminiumalaun | weiß | |
| Nickel(II)-sulfat | Xn | grasgrün |
| Eisen(III)-chlorid oder
Ammonium-Eisenalaun |
Xi | gelbbraun |
| Eisen(II)-sulfat | Xn | hellgrün |
| Cobalt(II)-chlorid | Xn | rosa |
| Mangan(II)-sulfat | Xn N | rosa bis braun |
| Kalium-Chromalaun | violett bis grün |
Achtung: Wasserglaslösungen sind stark alkalisch und
deshalb ätzend!
|
Versuch 1: Chemischer Garten
Die Versuche sollten Sie von den Schülern auch im Reagenzglas durchführen lassen - mit weniger Wasserglaslösung und mit jeweils einer Kristallsorte. |
Klick mich an!
Bild 2: Chemischer Garten (Gartengestaltung und Foto: Daggi)
Pflegetipps für den chemischen Garten
Die Mischung darf nicht eintrocknen. Sie müssen die Gärtchen deshalb in verschlossenen
Gefäßen aufbewahren - aber immer daran denken, dass der Inhalt stark ätzend ist! Kleinkinder
dürfen damit nicht in Kontakt kommen.
Achten Sie auf niedrige Umgebungstemperatur, damit die empfindlichen Bäumchen nicht durch die Wärmebewegung in der Flüssigkeit beim Wachstum gestört oder nach dem Wachsen zerstört werden. Also das Gefäß z. B. nicht über die Heizung stellen!
Außerdem sind die Bäumchen mechanisch empfindlich.
Das Gefäß kann, wenn es gut behandelt wird und nicht soviel herumgetragen wird, jahrelang stehen bleiben und einen erfreuen!
Zur Entsorgung
Wenn man des chemischen Gärtchens überdrüssig ist und man es entsorgen will, muss man einiges bedenken.
Die Flüssigkeit darf auf keinen Fall in die Toilette oder ins Waschbecken gespült werden. Die stark alkalische Lösung belastet nicht nur die Umwelt, sondern zerstört die Porzellanglasur von Waschbecken oder Toilette augenblicklich!
Am besten geht man so vor: Die Gefäße werden in eine Plastikfolie gestellt und vorsichtig mit Sand, Erde oder Küchenpapier aufgefüllt, um die Flüssigkeit aufzusaugen. Dann werden die Gefäße samt Inhalt in den Hausmüll gegeben.
Schulen geben die Gefäße samt Inhalt zum Schwermetallabfall.
Chemischer Hintergrund
(Natron-)Wasserglas ist eine konzentrierte Lösung von Natriumsilicaten. Man stellt letztere her, indem
man feinpulverisierten Quarz mit festem Natriumhydroxid erhitzt und so aufschließt (->
Versuch). Formal gilt:
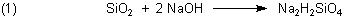
Genau genommen bildet sich vor allem Natriumtrisilicat Na2Si3O7.
Wenn man das in Wasser oder besser noch in Natronlauge löst, entsteht Natron-Wasserglas.
Die darin enthaltenen Silicat-Anionen bilden mit den Metallkationen der oben angeführten Salze schwerlösliche Verbindungen. Formal können wir schreiben:
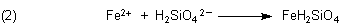
Wenn nun zum Beispiel ein Kristall von einem löslichen Eisensalz mit Wasserglas zusammenkommt, beginnt
sich der zu lösen. Die freigesetzten Eisen-Ionen reagieren sofort zu schwerlöslichem Eisensilicat, das sich
als dünnes Häutchen um den Kristall legt. Das wirkt wie eine halbdurchlässige („semipermeable“) Membran:
Es können nur die kleinen Wassermoleküle passieren, nicht aber die vor allem wegen ihrer Hydrathülle voluminösen
und dazu noch positiv geladenen Metallkationen. Von Innen kann deshalb nichts nach außen gelangen, umgekehrt
dringt aber Wasser ein. Durch den sich aufbauenden osmotischen Druck:
bläht sich die Silicathaut so lange auf, bis sie an einer Stelle aufplatzt. Es fließt etwas Eisensalzlösung nach
außen und bildet wieder eine Haut - und so weiter. Durch das ständige Wechselspiel zwischen Umhüllen und Platzen und
Wiederumhüllen scheint mehr oder weniger ruckartig eine Pflanze zu entstehen.
Warum wachsen die chemischen Pflanzen überhaupt nach oben?
Man könnte ja auch meinen, dass sie schwerer sind als die Wasserglaslösung und deshalb am Boden entlang „kriechen“ sollten.
Die Ursache ist, dass sich beim Lösen der Salze ständig Gasbläschen bilden, die für den nötigen Auftrieb der Pflanzenspitzen sorgen.
Dabei handelt es sich um Luft, die bei der Kristallisation in den sich bildenden Salzkristallen eingeschlossen wurde und
die nun beim Lösen wieder freigesetzt wird.
Hinzu kommen auch Aussalzungseffekte hinsichtlich der im Wasserglas gelösten Luft.
Das ist so, als wenn Sie Salz in Mineralwasser gießen.
Andere chemische Gärten
Natürlich gibt es noch andere Varianten vom oben beschriebenen chemischen Garten. Hier ist ein Beispiel:
|
Versuch 2: Chemischer Garten
|
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 12. März 2010, Dagmar Wiechoczek
