Umrechnen von ln in log oder in ld - eigentlich ganz einfach
Experimente:
Versuch: Reaktionskinetik der Entfärbung von Kristallviolett
Viele Gleichungen aus der physikalischen Chemie enthalten aufgrund ihrer
Herleitung (Integration von Gleichungen des Typs dx/x) den natürlichen
Logarithmus. Bekannte Beispiele sind Konzentrations/Zeit-Gleichungen aus der
Reaktionskinetik, etwa für Reaktionen 1. Ordnung.
ln c = ln co - k · t
Da ist aber auch die Nernstsche Gleichung zu nennen, die die EMK als Funktion der Konzentration der Redoxpaare definiert.
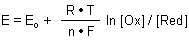
Andere Gleichungen enthalten von vornherein den dekadischen Logarithmus. Bekannt ist die Puffergleichung (auch Henderson-Hasselbalchsche Gleichung genannt).
pH = pK + log [A-] / [AH]
Das gilt auch für die Ausgangsgleichung des Lambert-Beerschen Gesetzes, das die Extinktion von elektromagnetischer Strahlung definiert.
log I = log Io - e · c · d
Wir halten fest:
Es gibt in der Chemie zwei wichtige Formen des Logarithmus:
- den dekadischen Logarithmus log mit der Basis 10
- den natürlichen Logarithmus ln mit der Basis e.
(Die Eulersche Zahl ist e = 2,718...)
(Dazu kommt noch der duale Logarithmus ld mit der Basis 2. Der ist wichtig, wenn
es um Information, Wahrscheinlichkeiten und Entropie geht.)
Wie kann man die verschiedenen Logarithmen ineinander
umrechnen?
Wir gehen dazu ganz formal vor:
Die Potenzgleichungen sind
(1a) y = 10x
(1b) y = ex
Nun logarithmiert man nach der zugehörigen Basis:
(2a) log y = x
(2b) ln y = x
Jetzt logarithmieren wir (1a) und (1b) jeweils nach der anderen Basis:
(3a) ln y = x · ln 10
(3b) log y = x · log e
Wir setzen nun x aus den zugehörigen Gleichungen (2a) und (2b) in (3a) und (3b) ein.
(4a) ln y = log y · ln 10
(4b) log y = ln y · log e
Wir stellen um:
(5a) log y = ln y / ln 10
(5b) ln y = log y / log e
Teilen wir (5a) durch (5b), so erhalten wir die fundamentale Beziehung:
(6) log e = 1 / ln 10
Zur Prüfung setzen wir die Werte der Logarithmen ein:
(7a) ln 10 = 2,303
(7b) log e = 0,4343
Für eine gegebene Zahl N ist der Wert des natürlichen Logarithmus größer als der des dekadischen. Sei N = 10, ist log N = 1 und ln N = 2,303.
Nun setzen wir die Werte der Logarithmen (7a) und (7b) in die Gleichungen (5a) und (5b) ein:
(8a) log y = ln y / ln 10 = ln y / 2,303
(8b) ln y = log y / log e = log y · ln 10 = log y · 2,303
Beispielsweise hat der Ausdruck ln 2, welcher oftmals in der Reaktionskinetik und bei Berechnungen zur Radioaktivität auftaucht, den folgenden Zahlenwert:
(8c) ln 2 = log 2 · 2,303 = 0,3010 · 2,303 = 0,693
Allgemein gilt für Logarithmen mit beliebiger Basis a:
(9) a log y = b log y / b log a
Mit der Gleichung (9) können wir auch Logarithmen wie zum Beispiel mit der Basis a = 2 (den bekannten Logarithmus dualis, der in der Informationstheorie eine große Rolle spielt) berechnen. Dazu benötigen wir nur Zehnerlogarithmen (Basis b):
ld y = log y / log 2
Rechnen wir also den natürlichen Logarithmus (Basis e) in den dekadischen (Basis 10) um, so müssen wir mit 2,303 multiplizieren oder durch 0,4343 teilen. Denn der natürliche Logarithmus einer Zahl (Numerus) ist im Wert größer als der des dekadischen Logarithmus.
Beispiel:
ln 5 = log 5 / log e = log 5 · ln 10
1,609 = 0,699 / 0,4343 = 0,699 · 2,303
0,699 = 1,609 / 2,303 = 1,609 · 0,4343
Konkrete Beispiele
1 Reaktionen 1. Ordnung
(10) ln c = ln co - k · t
Wollen wir (um die Geschwindigkeitskonstante k zu ermitteln) zur Analyse auf der Ordinate statt ln y den Wert log y auftragen, setzen wir (4a) in (10) ein. Dann müssen wir die ganze Gleichung (10) durch ln10 teilen.
(11) log c = log co - k · t / 2,303
Die Steigung der Kurve ist dann auch nicht mehr k, sondern k / 2,303. Den realen
Wert von k erhalten wir, indem wir die Steigung der Geraden mit 2,303
multiplizieren.
Man erhält diese Gleichung auch, wenn man vom Konzentrations-Zeit-Gesetz für
Reaktionen 1. Ordnung ausgeht.
c = co · e- k · t
Wir logarithmieren von vornherein mit der Basis 10:
log c = log co - k · t · log e
Mit (6) folgt der gleiche Ausdruck wie (11):
log c = log co - k · t / 2,303
2 Nernstsche Gleichung
Der thermodynamisch hergeleitete Ausdruck
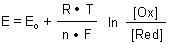
wird mit (4a) zu