
Stromerzeugung und Elektrolyse

Stromerzeugung und Elektrolyse
I. Chemische Reaktionen zur Stromerzeugung
II. Elektrolyse
Elektrischer Strom kommt bekanntlich aus der Steckdose und wird aus Kraftwerken verschiedenen Typs (Kohlekraftwerke, Atomkraftwerke etc.) in das Stromversorgungsnetz eingespeist. Wenn wir aber unabhängig vom Stromnetz ein elektrisches Gerät betreiben wollen, verwenden wir in der Regel Batterien zum einmaligen Gebrauch (z. B. im Walkman) oder wiederaufladbare Batterien, so genannte Akkumulatoren (z. B. die Autobatterie).
In diesem Abschnitt werden zunächst die chemischen Reaktionen betrachtet, die der Stromerzeugung durch Batterien und Akkumulatoren zugrunde liegen. Anschließend werden diese Reaktionstypen daraufhin untersucht, wie sie sich bei Stromzufuhr (anstatt Stromerzeugung) verhalten. Dieses Verfahren wird Elektrolyse genannt und dient u. a. zur Gewinnung von reinen Metallen und zum Überziehen von Oberflächen mit dünnen Metallschichten.
I. Chemische Reaktionen zur Stromerzeugung
Batterien wandeln chemische Energie in elektrische Energie um.
In vielen Batterien werden Metalle verarbeitet (z. B. in der Zink-Kohle-Batterie).
Im Abschnitt über die Metalle
wird gezeigt, dass diese unterschiedlich edel
sein können. Wenn ein Metall sehr unedel ist kann es leicht mit Sauerstoff oxidiert werden.
Edle Metalle werden nicht so leicht durch Sauerstoff oxidiert. Die
Oxidationsreihe der Metalle
kann durch einen entsprechenden Versuch
ermittelt werden.
Im Abschnitt über die Prinzipien von Reaktionen wird der
erweiterte Oxidationsbegriff
vorgestellt. Demnach ist eine Oxidation (neben der Aufnahme
von Sauerstoff) eine Abgabe von Elektronen.
Diese beiden chemischen Prinzipien lassen sich mit dem folgenden Ergebnis zusammenführen:
Versuch:
Elektrischer Strom aus der Kartoffel
Elektronenübertragungen zwischen Metallen
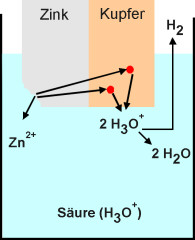
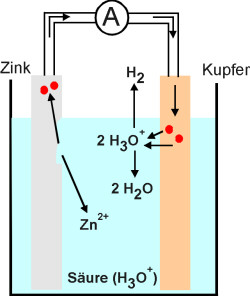
Berühren sich unterschiedliche Metalle (z. B. Zink und Kupfer) in einer den
elektrischen Strom leitenden Flüssigkeit, gibt das unedlere Metall (Zink) Elektronen
an das edlere Metall ab. Hierbei entstehen aus dem elementaren Zink Ionen (Zink-Kationen),
so dass sich das Metall langsam auflöst (s. Bild 1):
Zn à Zn 2+ + 2 e - (Oxidation)
Umgekehrt können Metall-Kationen auch Elektronen aufnehmen und zum elementaren Metall reagieren:
Ag + + e -à Ag (Reduktion)
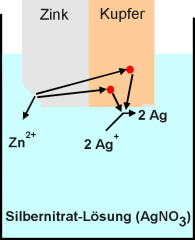
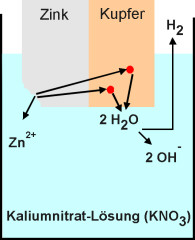
So angeordnete Metalle werden Elektroden genannt. Die den elektrischen Strom leitende Flüssigkeit wird als Elektrolyt bezeichnet. Dieser kann eine anorganische Säure oder eine Salzlösung sein. Die entstandenen Elektronen reduzieren dann je nach Elektrolyt die Oxonium-Ionen der Säure, die Metall-Kationen des Salzes oder die Wassermoleküle der Salzlösung (Bild 1).
Das "Auflösen" des unedleren Metalls wird auch als Korrosion bezeichnet.
 |
 |
 |
2 H3O + + 2 e - à 2 H2O + H2á |
2 Ag + + 2 e -à 2 Ag |
2 H2O + 2 e - à 2 OH - + H2 á |
Versuche:
Korrosionsverhalten von verzinntem Eisen (Weißblech) und verzinktem Eisen
Reinigen von Silber durch Kontaktkorrosion
| Die Reduktion von Oxonium-Ionen zu elementarem Wasserstoff und Wasser durch Metalle kennst du bestimmt auch aus einem anderen Zusammenhang. Überlege Dir einmal woher, und überprüfe es dann durch Anschauen der Lösung. |
Redox-Potentiale
Das unterschiedliche Vermögen der Metalle, Elektronen abzugeben (Oxidation), und das verschiedene
Bestreben von Metall-Kationen und anderen Stoffen, Elektronen aufzunehmen (Reduktion), kann in einer Reihe
in Zahlen erfasst (quantifiziert) werden. Diese Reihe heißt
Spannungsreihe der Metalle.
Die folgende Tabelle ist ein Auszug dieser Spannungsreihe. Jedes Metall (und einige Nichtmetalle) und dessen Ionen besitzen ein bestimmtes Vermögen, Elektronen abzugeben oder aufzunehmen, dessen Wert mit der Einheit Volt [V] beschrieben und als Redox-Potential bezeichnet wird.
|
|
|
|
Redox-Potential [V] |
 groß |
K + + e - à
K
Ca 2+ + 2 e - à Ca Na + + e - à Na Mg 2+ + 2 e - à Mg Al 3+ + 3 e - à Al 2 H2O + 2 e - à H2 + 2 OH - Zn 2+ + 2 e - à Zn O2 + e - à O 2- PbSO4 + 2 e - à Pb + SO4 2- Ni 2+ + 2 e - à Ni Pb 2+ + 2 e - à Pb 2 H + + 2 e - à H2 Cu 2+ + 2 e - à Cu O2 + 2 H2O + 4 e - à 4 OH - Ag + + e - à Ag O2 + 4 H + + 4 e - à 2 H2O Pb 4+ + 2 e - à Pb 2+ Au + + e - à Au |
 klein |
- 2,872+ - 2,71+ - 2,362+ - 1,663+ - 0,832 - 0,7622+ - 0,5622+ - 0,362 - 0,232 - 0,132+ 0,00 . 0,342 0,402- 0,80+ 1,232+ 1,674 1,69+ |
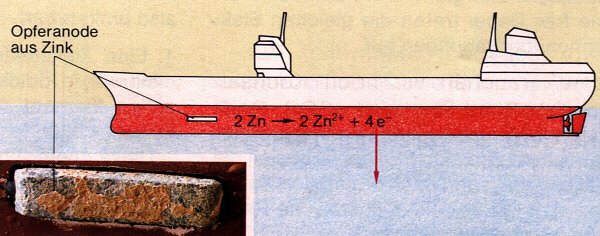
Lokalelemente
Wenn sich zwei Metalle im Elektrolyten berühren (Bild 1), spricht man von einem
Lokalelement.
Das Prinzip der Lokalelemente nutzt man auch zum Schutz von Eisenteilen
(z. B. Heizungsleitungen, Schiffsrümpfe und Autokarosserien) vor
Korrosion
(Rostschutz). Eisenteile, die mit Elektrolyten in Berührung kommen und so beginnen
zu rosten, werden mit unedlen Metallen (Zink, Magnesium oder Aluminium) leitend verbunden.
Durch langsames Auflösen des unedlen Metalls und Elektronenübertragung auf das
Eisen (Bild 2) wird die Oxidation des Eisens solange unterbunden, bis sich das unedle Metall
vollständig aufgelöst hat. Die Blöcke aus unedlem Metall nennt man Opferanoden,
da der
Plus-Pol
von Lokalelementen auch als Anode bezeichnet wird.
Versuch:
Ein Bleistiftanspitzer als Lokalelement (Modell der Opferanode)
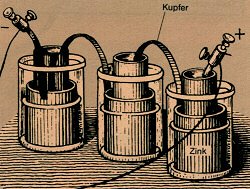
Galvanische Elemente
Aus Lokalelementen lässt sich noch kein elektrischer Strom bzw. keine elektrische
Energie verwerten, da die Elektronen direkt vom unedlen zum edlen Metall wandern und
anschließend einen Bestandteil des Elektrolyten reduzieren. Trennt man die
unterschiedlichen Metalle räumlich voneinander und verbindet sie z. B. über einen
Motor, kann der Stromfluss vom unedleren zum edleren Metall genutzt werden.
Ein solches Element heißt Galvanisches Element (Bild 3).
Die
Das in Bild 3 schematisierte, galvanische Element ist eines der ältesten und wurde nach seinem Entdecker Allesandro Volta (1745-1827) benannt. Es heißt Volta-Element. Die Spannung eines solchen galvanischen Elements (in Volt) kann aus der Differenz der einzelnen Potentiale der Spannungsreihe berechnet werden. Im Folgenden wird für das Volta-Element eine vereinfachte Rechnung gezeigt:
|
Reaktion |
Potential (in Volt) |
|
Zn à Zn 2+ + 2 e - |
0,76 V |
|
2 H + + 2 e - à H2 |
0,00 V |
|
|
0,76 V (Spannung) |
Versuche:
Die Silberbesteck-Batterie
Die "Salzbatterie"
Schaltet man mehrere solcher einfachen, galvanischen Elemente (Monozellen) hintereinander, addieren sich die Spannungen der einzelnen Elemente (Bild 4).

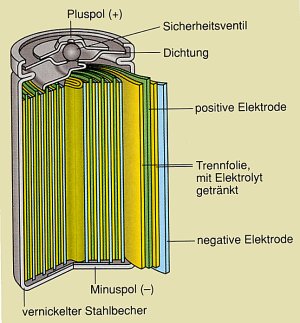
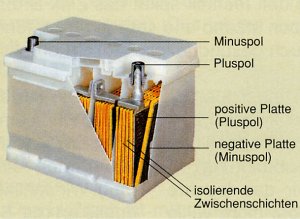
Akkumulatoren
Neben herkömmlichen Batterien, deren elektrische Spannung mit der Zeit
erschöpft ist, weil die Elektrolytlösung vollständig reduziert
wurde oder sich das unedle Metall nahezu vollständig aufgelöst hat, gibt es
auch Akkumulatoren (Akkus). Diese können, nachdem sie sich entladen haben,
durch Zuführen von elektrischem Strom (Elektronen) wieder aufgeladen werden.
Die Lade- und Entladevorgänge des Nickel-Cadmium-Akkus und des Blei-Akkus (Tabelle 2) zeigen, dass
die Umwandlung von chemischer Energie in elektrische Energie (galvanischer Elemente) reversibel,
d.h. umkehrbar ist.
Der Ladevorgang ist eine Elektrolyse, die im folgenden Abschnitt näher
beschrieben wird. Die Autobatterie (Blei-Akku) und Nickel-Cadmium-Rundzellen sind
Beispiele für Akkumulatoren (Tabelle 2).
|
|
|
 |
 |
|
Plus-Pol: Ni 4+ + 2 e -à Ni 2+ |
Plus-Pol: Pb 4+ + 2 e - à Pb 2+ |
|
Plus-Pol-Pol: Ni 2+ à Ni 4+ + 2 e - |
Plus-Pol: Pb 2+ àPb 4+ + 2 e - |
Versuch:
Funktionsweise eines aufgesägten Nickel-Cadmium-Akkus
Funktion einer Autobatterie (Blei-Akku)
II. Elektrolyse
Im vorherigen Abschnitt wurde bereits gezeigt, dass Kationen edler
Metalle (z. B. Kupfer-Kationen) in Lösung durch unedle Metalle (z. B. Zink) reduziert
werden können. Bei diesem Vorgang ist das unedle Metall das
Reduktionsmittel, da
es Elektronen abgibt, die von den Metall-Kationen in Lösung
aufgenommen werden. Das stärkste Reduktionsmittel sind aber
die Elektronen selbst, also elektrischer Strom.
Aus diesem Grund können mit Hilfe
des elektrischen Stroms Metalle aus ihren Salzlösungen abgeschieden werden. Dieses
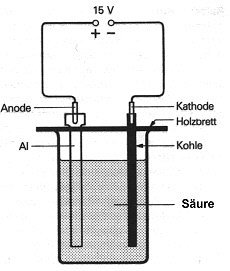
Verfahren heißt Elektrolyse (Bild 5).
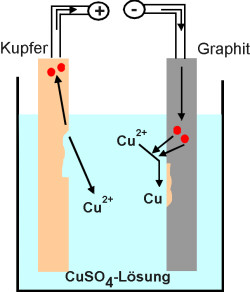
Am Minus-Pol werden die Metall-Kationen zum elementaren Metall reduziert
(Aufnahme von Elektronen).
 Konservendose (Quelle: Cornelsen) |
Metallüberzüge
Die elektrolytische Metallabscheidung dient unter anderem dazu, Oberflächen
mit einer dünnen Metallschicht zu überziehen. So werden z. B. Fahrradlenker verchromt,
Konservendosen verzinnt oder Bestecke versilbert.
Versuch:
Vernickeln eines Groschens
 Kupferraffination (Quelle: Cornelsen) |
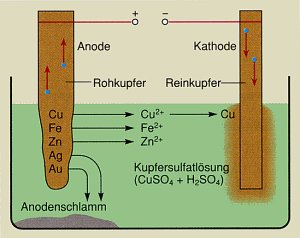
Metallgewinnung
Mit Hilfe der Elektrolyse lassen sich aber auch reine Metalle je nach ihrem
Vorkommen in der Natur auf unterschiedliche Weise gewinnen. Erze werden in der Regel
zunächst in ihre Salzlösungen überführt, die anschließend
elektrolysiert werden. Metalle, die in der Natur mit anderen Metallen elementar
vergesellschaftet vorkommen, werden direkt durch das Elektrolyse-Verfahren getrennt.
Versuch:
Elektrolytische Kupferraffination
Gewinnen von Zink aus Zinkoxid
Eloxal-Verfahren
Im Fall des Aluminiums, welches schon an der Luft eine dünne
Oxidhaut bildet, kann mit Hilfe der Elektrolyse diese schützende Oxidschicht
verstärkt werden. So können die Aluminiumteile auch ohne Schutzanstrich vor Korrosion
geschützt werden. Dieses Elektrolyse-Verfahren heißt Eloxal-Verfahren
(elektrolytische Oxidation des Aluminiums)
(Bild 8). Da sich die Oxidschicht leicht einfärben lässt, können so gleich farbige Aluminiumteile
hergestellt werden, wie sie z. B. von bunten Fensterrahmen aus Aluminium bekannt sind (Bild 9).
|

(Quelle: Cornelsen) |
Versuch:
Eloxieren von Aluminium
Anfärben von eloxiertem Aluminium
Weitere Texte zum Thema „Chemie im und ums Haus“