
Saure und alkalische Lösungen
I. Indikatoren und der pH-Wert
II. Eigendissoziation des Wassers
III. Saure Lösungen
IV. Alkalische Lösungen
V. Neutralisation
Aus dem Haushalt kennst du bestimmt viele Lebensmittel, die sauer schmecken, wie z. B.
Zitronensaft und Essig. Beide enthalten
organische Säuren. Eine anorganische
Säure ist die Phosphorsäure (H3PO4), die zum Ansäuern
von Cola-Getränken benutzt wird. Der saure Geschmack dieser Stoffe wird von unserer
Zunge erkannt. Weil die menschliche Zunge auch den süßen Geschmack erkennen kann,
wird "süß" und "sauer" aus geschmacklicher Sicht als Gegensatz
empfunden. Aus chemischer Sicht stimmt dies jedoch nicht, da z. B. saure Getränke durch
Süßen mit Zucker ihre saure Eigenschaft nicht verlieren, sondern ihr saurer
Geschmack nur durch den zugefügten, süßen Zucker überlagert wird. Aus
chemischer Sicht ist der Gegensatz zu sauren Lösungen die alkalische
Lösung. Auf der Haut fühlen sich alkalische Lösungen schlüpfrig an,
wie z. B. die Seife. Vielleicht hast du schon einmal etwas Seife in den Mund bekommen, dann
weißt Du, dass sie seifig schmeckt, ein Geschmack, der auch für andere
alkalische Lösungen zutrifft. Flüssigkeiten, die weder saure noch alkalische
Eigenschaften zeigen sind neutrale Lösungen.
In diesem Abschnitt wird genauer untersucht, warum saure und alkalische Lösungen
chemisch gesehen Gegensätze sind. Zunächst soll aber eine Möglichkeit
dargestellt werden, wie saure und alkalische Lösungen ohne eine Geschmacksprobe
unterschieden werden können. Denn Geschmacksproben sind bei chemischen
Untersuchungen nie erlaubt, da viele Stoffe ätzend, giftig oder auf eine
andere Art gesundheitsschädlich sein können.
 Universalindikatorpapiers (Quelle: nach [43]) |
I. Indikatoren und der pH-Wert
Der Begriff "Indikator" stammt vom lateinischen Wort "indicare" ab, was soviel
wie "anzeigen" bedeutet. Ein Indikator ist also (ganz allgemein gesehen) ein Hilfsmittel,
welches dem Menschen gewisse Informationen übermittelt (bzw. anzeigt). So zeigt der
Tachometer im Auto die momentane Geschwindigkeit an.
In der Chemie werden neben verschiedenen anderen Indikatoren auch solche verwendet,
die anzeigen, ob ein Stoff bzw. dessen Lösung in Wasser sauer, alkalisch oder neutral
reagiert. Diese nennt man Säure-Base-Indikatoren. Basen bzw. basische
Lösungen sind andere Bezeichnungen für Alkalien und alkalische Lösungen.
Diese Indikatoren sind Farbstoffe, die je nach Zugabe zu einer sauren, alkalischen
oder neutralen Lösung die Lösung unterschiedlich färben. Viele farbige
Naturstoffe (z. B. die aus roten Weintrauben) können als Säure-Base-Indikator
wirken.
Auch Rotkohlsaft zeigt diese Eigenschaft. Vielleicht hast du schon einmal jemandem
beim Kochen von Rotkohl zugesehen. Nachdem der Kohl schon einige Zeit gekocht worden ist,
wird er häufig mit Essig gewürzt. Hierbei verändert sich die Farbe des Kohls
schlagartig von violett nach rot. Rotkohl kann sogar mehrere Farben zeigen. Dies hängt
davon ab, wie stark (konzentriert) die zugegebene Säure bzw. alkalische Lösung ist.
So reicht seine Farbskala von Rot über Lila bis Kornblumenblau und weiter über
Grün bis Gelb.
Die Konzentration einer sauren oder einer basischen Lösung wird als pH-Wert bezeichnet. Sehr starke Säuren können den pH-Wert 1, besonders starke alkalische Lösungen den pH-Wert 14 besitzen. So kann eine Skala (pH-Wert-Skala) von 1 bis 14 angelegt werden, wobei neutrale Lösungen den pH-Wert 7 (genau in der Mitte) besitzen. Mit Universalindikatoren, die ähnlich dem Rotkohl je nach pH-Wert eine unterschiedliche Farbe anzeigen, können unbekannte Lösungen auf Säure- bzw. Basenstärke grob überprüft werden (Bild 1). Ein genauer pH-Wert, der auch die Stellen hinter dem Komma (z. B. pH = 4,75) berücksichtigt, kann nur mit einem genauen Messgerät ermittelt werden.
Versuche:
Wir untersuchen Stoffe im Haushalt auf saure und alkalische Eigenschaften
Die gepufferte Schönheit des Rotkohlsafts
II. Eigendissoziation des Wassers
Saure und alkalische Lösungen müssen sich chemisch unterscheiden,
damit sie von einem Indikator erkannt werden können. Hierfür spricht auch
die Tatsache, dass saure und alkalische Lösungen im Gegensatz zu neutralen
Lösungen den elektrischen Strom leiten.

Dieses Phänomen heißt Eigendissoziation des Wassers. Es sind aber nur
sehr, sehr wenige Wassermoleküle, die dissoziieren.
Bei der Eigendissoziation des Wassers entstehen aber auch OH - -Ionen
(Hydroxid-Ionen). Sie prägen die alkalische Eigenschaft von Lösungen,
weshalb die
Hydroxide zur Gruppe der Basen gehören. Indikatoren zeigen die
Anwesenheit von Hydroxid-Ionen an.
III. Saure Lösungen
Saure Lösungen können durch Lösen von
Nichtmetalloxiden in Wasser
entstehen. Als Beispiel dient hier die Kohlensäure. Sie entsteht durch das Lösen
von Kohlenstoffdioxid (CO2) in Wasser:
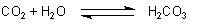
Aus diesem Grund schmeckt Mineralwasser sauer. Mit Indikatoren versetzt, zeigt Mineralwasser eine saure Lösung an. Das gelöste Kohlenstoffdioxidgas, welches für die Bildung der Kohlensäure verantwortlich ist, kann durch Erwärmen des Wassers aber wieder aus der Lösung als Gas ausgetrieben werden. Deshalb wird das Gas Kohlenstoffdioxid fälschlicherweise häufig als Kohlensäure bezeichnet.
Versuche:
Löslichkeit von Kohlendioxid in Abhängigkeit von der Temperatur
Modellversuch zur Verwitterung des Kalksteins (Wasserhärte)
Herstellen von Salzsäuregas aus einem WC-Reiniger und Kochsalz
Herstellen von schwefliger Säure
Modellversuch zum sauren Regen
Phosphorsäure aus der Streichholzschachtel
Herstellen von Kalksandsteinen
|
|
|
|
|
|
|
Lötwasser, Entkalker,
Metallätzung, Magensaft |
|
|
|
Batteriesäure (Autobatterie) |
|
|
|
Säuerungsmittel in
Cola-Getränken,
Rostlöser |
|
|
|
Gold- und Platin-Indikator
für Juweliere
(Nachweis sehr edler Metalle) |
|
|
|
Mineralwasser |
Versuche:
Es gibt auch saure Salze (Hydrogensalze), die ein acides Wasserstoffatom besitzen und in Wasser gelöst Oxonium-Ionen bilden:Beispiel:
2 NaHSO4 + 2 H2O à Na2SO4 + SO4 2- + 2 H3O +Versuch:
Herstellen von Salzsäuregas aus einem WC-Reiniger und Kochsalz
Versuche:
Reaktion von Säuren mit unedlen Metallen
Nachweis von Calciumcarbonat in Scheuermitteln
Bau eines Kohlendioxid-Schaumlöschers (Modellversuch)
Herstellen von Schaumgips mit Calciumcarbonat
IV. Alkalische Lösungen
Die meisten alkalischen Lösungen sind wässrige Lösungen von
Hydroxiden, wie z. B. von Natriumhydroxid. Hydroxide zerfallen (dissoziieren) in
Wasser zu Metall-Ionen und Hydroxid-Ionen, wobei die Anwesenheit letzterer durch
Indikatoren angezeigt wird. Sie bewirken auch die Eigenschaft, dass sich ihre
Lösungen seifig anfühlen.
 |
Versuche:
Untersuchen eines Rohrreinigers
Nachweis von Alkalien, Tensiden und Bleichmitteln in Scheuermitteln
Basische Reaktion von Zement in Wasser
Vom Kalk zum Branntkalk und Löschkalk
Wasseraufnahme beim Abbinden von Zement
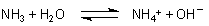
Die Reaktion von Wasser mit basischen Salzen (z. B. Soda) verläuft ähnlich:
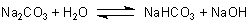
Versuche:
Herstellen einer einfachen Waschlauge aus Asche
Basische Reaktion von Seife mit Wasser
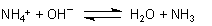
Versuch:
Ammoniak aus Hirschhornsalz
V. Neutralisation
Saure und alkalische Lösungen können miteinander reagieren. Diese
Reaktion ist eine Neutralisationsreaktion zwischen den Oxonium-Ionen bzw. H +-Ionen der sauren
Lösung und den Hydroxid-Ionen bzw. der alkalischen Lösung.
Wenn gleiche Mengen beider Ionen-Sorten miteinander reagieren, entsteht eine neutrale
Salzlösung.
Versuch:
Neutralisation in der Spülmaschine (Modellversuch)
Weitere Texte zum Thema „Chemie im und ums Haus“