
Tenside und Waschmittel
I. Waschen mit Wasser und Tensiden
II. Seife - Eines der ältesten Tenside
III. Moderne Waschmittel
Um Kleidung, Geschirr oder die menschliche Haut von Fetten und Schmutz zu reinigen, werden Tenside eingesetzt. Die wohl ältesten Tenside sind die Seifen. Ihre Herstellung war schon den alten Ägyptern und auch den Germanen bekannt. Inzwischen gibt es eine Reihe neuer, hochentwickelter Tenside, die auf die unterschiedlichen Anwendungsbereiche abgestimmt sind. So werden Tenside in Geschirrspülmitteln für die Hand- und Maschinenreinigung, Klarspülern, diversen Haushaltsreinigern, Shampoos, Duschgelen, Handwaschpasten, Waschmitteln und Weichspülern verwendet.
I. Waschen mit Wasser und Tensiden
Jede Flüssigkeit besitzt eine bestimmte Oberflächenspannung, die
vom Stoff und evtl. darin gelösten anderen Stoffen abhängig ist. Wird die
Flüssigkeit zum Teil von Luft umgeben, spricht man von der Grenzflächenspannung
zwischen der flüssigen und der gasförmigen Phase. Löst man Tenside in Wasser,
so wird die ursprüngliche Oberflächenspannung des Wassers bzw. die
Grenzflächenspannung zwischen Wasser und Luft deutlich verringert. In diesem Fall
spricht man auch von entspanntem Wasser.
Versuche:
Herabsetzen der Grenzflächenspannung zwischen Wasser und Luft
Verhalten von Flüssigkeiten mit unterschiedlicher Oberflächenspannung
Tenside wirken wie Emulgatoren, da sie ähnlich aufgebaut sind. Sie besitzen in ihren Molekülen ein hydrophiles (wasserfreundliches) und ein hydrophobes (in Wasser nicht lösliches) Ende. Beim Waschen dringen die hydrophoben Enden der Tenside in die Textilfaser und die Schmutzteilchen ein, während die hydrophilen Enden ins Wasser ragen. Durch Bewegung der Wäschestücke während des Waschvorgangs, werden die Schmutzteilchen abgelöst, dispergiert (zerteilt) und emulgiert (Bild 1).
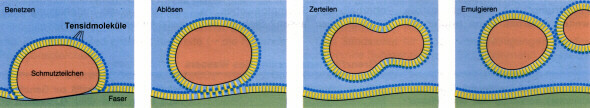
Bild 1: Waschwirkung von Tensiden (Quelle: Cornelsen)
Versuche:
Emulgiervermögen von Seife
Dispergiervermögen von Seife
II. Seife - Eines der ältesten Tenside
Rohstoffe für die Seifenherstellung sind pflanzliche und tierische Fette. Diese werden
mit Laugen verseift, so dass Glycerin und die Salze der einzelnen Fettsäuren
entstehen. Auf dieser Verseifungsreaktion beruht auch der Einsatz von starken Alkalien, wie z. B. Kaliumhydroxid (KOH),
in Backofenreinigern, da sie die eingebrannten Fette in die wasserlöslichen Salze der Fettsäuren überführen.
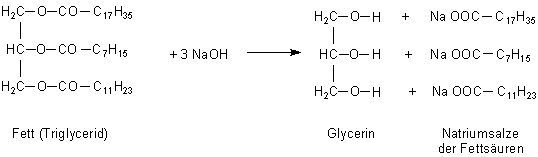
Bild 2: Beispiel für die Verseifung von Fetten mit Natronlauge
Versuche:
Herstellen von Kernseife
Nachweis von Glycerin nach der Verseifung eines Fettes
Herstellen einer einfachen Waschlauge aus Asche
Untersuchen von Kernseife auf die Elemente Kohlenstoff und Wasserstoff
In wässriger Lösung liegen die negativ geladenen Fettsäureteilchen (Seifenanionen) frei vor, so dass Seife als anionisches Tensid bezeichnet wird. Die Seifenanionen bilden die hydrophilen Enden und die Fettsäurereste die hydrophoben Enden dieses Tensids. Natriumsalze der Fettsäuren nennt man Kernseife, ein festes Seifenprodukt, die Kaliumsalze der Fettsäuren werden als Schmierseife bezeichnet, da sie ein zähflüssiges Produkt ist.
Wässrige Seifenlösungen reagieren alkalisch (Seifenlauge), da ein Teil der Seifenanionen mit Wasser zu Hydroxid-Ionen und den wasserunlöslichen Fettsäuren reagiert:
Beispiel: C17H35COO - + H2O à C17H35COOH + OH -
Aufgrund der Basizität von Seifenlösungen brennen diese in den Augen. Weiterhin zerstören sie durch Neutralisation den Säureschutzmantel der Haut, weshalb gerade in modernen, pH-neutralen Waschlotionen andere Tenside als die Seifen verarbeitet werden.
Versuche:
Basische Reaktion von Seife mit Wasser
Reaktionen von Seifenlösungen mit Säuren und Basen
In hartem Wasser büßen die Seifen einen großen Teil ihrer Waschwirkung ein, da sie mit den Calcium-Ionen zu unlöslichen Kalkseifen reagieren:
Beispiel: 2 C17H35COO - + Ca 2+ à (C17H35COO)2 Ca
Außer der verminderten Waschwirkung hat die Bildung von Kalkseifen einen weiteren
Nachteil. Sie setzen sich im Gewebe ab und machen damit die Wäsche hart und grau. Aus
diesen Gründen werden Seifen nicht mehr in Waschmitteln und kaum noch in
Körperreinigungsmitteln verwendet, sondern ausschließlich als Handseifen oder
eben als Kern- und Schmierseife zur Reinigung von Böden oder anderen Flächen
angeboten.
Weitere Informationen und Experimente zur Wasserhärte befinden sich auf der folgenden
Web-Seite:
| Mit dem folgenden LINK kommst du auf eine neue Web-Seite. Um zu dieser zurückzugelangen, musst du auf der neuen Seite das [X]-Symbol (oben rechts) anklicken. Wasserhärte: Informationen und Experimente zur Wasserhärte |
III. Moderne Waschmittel
Waschmittel sind aus verschiedenen, funktionellen Bestandteilen (Tensiden,
Wasserenthärtern und Bleichmitteln) zusammengesetzt:
Tenside
Heute setzt man zum Waschen fast nur noch synthetische Tenside ein.
Ihre Moleküle enthalten keine hydrophile COO- -Gruppe wie die Seifen,
so dass sie in Wasser nicht alkalisch wirken und auch keine
Kalkseifen bilden.
Je nach Ladung dieser hydrophilen Gruppe unterscheidet man anionische,
kationische und nichtionische Tenside. Anionische Tenside bilden
negativ geladene Ionen und finden in Waschmitteln für alle Textilien
Verwendung. Kationische Tenside bilden positiv geladene Ionen. Sie besitzen keine
große Waschwirkung, haften jedoch gut am Gewebe und verhindern die elektrostatische
Aufladung von Textilien, weshalb sie Weichspülern und Wollwaschmitteln zugesetzt werden.
Nichtionische Tenside zerfallen nicht in Ionen. Die hydrophilen Gruppen dieser Tenside enthalten
vielfach Hydroxy-Gruppen (OH-Gruppen) oder andere, gut wasserlösliche Gruppen. Diese
Tenside werden neben Textilwaschmitteln vor allem auch in Spülmitteln und vielen anderen
Haushaltsreinigern verwendet.
Versuch:
Nachweis von kationischen, anionischen und nichtionischen Tensiden in Reinigungsmitteln
Aufgrund der zahlreich vorkommenden lipophilen Fettsäurereste in Fetten geht man meistens von diesen als nachwachsende Rohstoffe zur Herstellung von Tensiden aus.
Wasserenthärter (Builder)
Obwohl moderne Tenside mit Calcium-Ionen keine Kalkseifen bilden, werden
Waschmitteln Wasserenthärter zugesetzt, da Calcium- und Magnesiumsalze beim Trocknen der
Textilien scharfe und spitze Kristallnadeln bilden, die das Gewebe mit der Zeit beschädigen
würden.
Während bis in die 70er Jahre in deutschen Waschmitteln das umweltschädigende Pentanatriumtriphosphat (PNT) als Wasserenthärter verwendet wurde, welches über das Abwasser zu einem übermäßigen Algenwachstum in Flüssen und Seen führt (Eutrophierung), wird heute auf diese Form der Wasserenthärtung verzichtet (phosphatfreie Waschmittel). Als Ersatz wird Vollwaschmitteln das so genannte Zeolith A (ein Natriumaluminium-Silicat, Bild 3) zugesetzt. Dies sind Kristalle mit Hohlräumen, in denen sich Natrium-Ionen befinden. Sie werden beim Waschen durch Calcium- und Magnesium-Ionen ausgetauscht und wirken deshalb nach dem Prinzip der Ionenaustauscher.
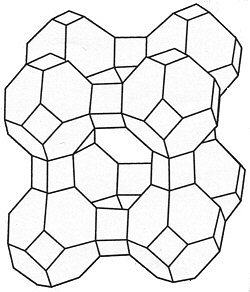
Bild 3: Bau eines Zeolith A-Kristalls.
Im Hohlraum finden die Metall-Ionen Platz
Versuche:
Wirkung von Buildern
Vollwaschmittel enthärten Wasser
Beimengungen von Soda (Na2CO3) unterstützen die wasserenthärtende Wirkung von Zeolith A und verbessern unter anderem die Granulierungseigenschaften pulverförmiger Waschmittel [25].
Versuch:
Nachweis von Soda in Waschmitteln
Bleichmittel
Da sich nicht alle Verschmutzungen durch Tenside beseitigen lassen
(z. B. Obst-, Gemüse- oder Kaffeeflecken), werden modernen Waschmitteln Bleichmittel
zugefügt, die in wässrigen Lösungen zerfallen und atomaren Sauerstoff
bilden. Dieser wirkt stark oxidierend, wodurch die Farbstoffe zerstört werden. Als
Bleichmittel werden Natriumperborat und Natriumpercarbonat verwendet. Letzteres ist auch
Bestandteil diverser Fleckensalze. In Entfärbern werden dagegen Stoffe verwendet, die durch
Reduktion die Farbstoffe zerstören.
Versuche:
Sauerstoff aus Fleckensalz
Nachweis von Alkalien, Tensiden und Bleichmitteln in Scheuermitteln
Reduktionswirkung von Natriumdithionit in Entfärbern
Weitere Texte zum Thema „Chemie im und ums Haus“