Organische Säuren
I. Eigenschaften von Carbonsäuren
II. Hydroxycarbonsäuren
III. Carbonsäureester
IV. Ascorbinsäure
Organische Säuren nennt man auch Carbonsäuren. In der häuslichen Umgebung sind zahlreiche Carbonsäuren und Carbonsäureprodukte vertreten: Ihren sauren Geschmack kennen wir z. B. von Citrusfrüchten (Citronensäure), Sauerkraut und Joghurt (Milchsäure), Rhabarber (Oxalsäure) und natürlich vom Speiseessig (Essigsäure). Auch das Schmerzmittel Aspirin® ist eine Carbonsäure. Seifen sind Natrium- und Kaliumsalze von Fettsäuren, die in Fetten und fetten Ölen in Form von Estern gebunden sind. Einige Carbonsäuren, wie z. B. die Terephthalsäure, sind Ausgangsstoffe für Kunststoffe (Trevira®). Eine Ausnahme bildet die Ascorbinsäure (Vitamin C). Sie zählt ebenfalls zu den organischen Säuren, obwohl sie keine Carbonsäure ist.
I. Eigenschaften von Carbonsäuren
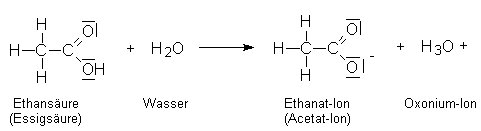
Carbonsäuren unterscheiden sich von anorganischen Säuren
(mit Ausnahme der Kohlensäure) darin, dass ihre Moleküle immer aus den
Elementen Kohlenstoff, Wasserstoff und Sauerstoff aufgebaut sind. Die chemischen
Eigenschaften der Carbonsäuren werden durch ihre funktionelle Gruppe, die Carboxylgruppe
(COOH-Gruppe) bestimmt. Wird eine Carbonsäure in Wasser gelöst, reagiert ein Teil
ihrer Moleküle mit den Wassermolekülen unter Protonenabgabe. So entstehen
Oxonium-Ionen, die die saure Eigenschaft von verdünnten Carbonsäurelösungen
verursachen:

Bild 1: Reaktion von Carbonsäuren in Wasser
Einige Carbonsäuren, wie z. B. die Oxalsäure, verfügen in
ihren Molekülen über mehrere Carboxylgruppen.
Neben der Carboxylgruppe bestimmt auch der so genannte Rest, an dem die funktionelle
Gruppe hängt, weitere Eigenschaften der Carbonsäuren, wie z. B. die Löslichkeit
in hydrophilen und lipophilen Lösemitteln und den Aggregatzustand bei Raumtemperatur.
Versuche:
Untersuchung von Citronensäure auf die Elemente Kohlenstoff und Wasserstoff
Gewinnen von Essigsäure
Untersuchen von Aspirin®
Reaktion von Säuren mit unedlen Metallen
Herstellen von Schaumgips mit Calciumcarbonat
Oxalsäure als Lösungsmittel für Rost
Nachweis von Huminsäuren in schwarzem Tee und Torf
II. Hydroxycarbonsäuren
Einige Carbonsäuren tragen in ihren Molekülen neben den Carboxylgruppen
auch Hydroxygruppen (OH-Gruppen). Sie werden Hydroxycarbonsäuren genannt und kommen
vorwiegend in Früchten und vergärten Milchprodukten vor:
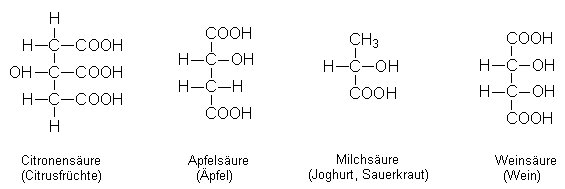
Bild 2: Molekülstrukturen einiger Hydroxycarbonsäuren
Eine besondere Eigenschaft einiger Hydroxycarbonsäuren ist die Fähigkeit, Metall-Ionen zu binden.
Versuche:
Hydroxycarbonsäuren in Lebensmitteln
Der Einfluss von Hydroxycarbonsäuren auf den Zahnschmelz (Modellversuch)
III. Carbonsäureester
Carbonsäuren reagieren mit Alkoholen unter Kondensation zu Estern und
Wasser:
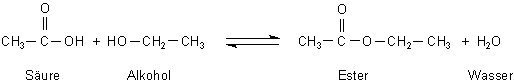
Bild 3: Kondensationsreaktion zur Bildung von Estern
Fette und fette Öle sind natürliche Ester
aus Fettsäuren und Glycerin.
Einige flüssige Ester zeichnen sich durch einen intensiven Geruch und Geschmack aus.
Sie werden zum Teil als Duft- und Aromastoffe verwendet.
Versuche:
Untersuchen von Aspirin®
Herstellen von Fruchtaromen
Ester werden aber auch als Lösemittel verwendet, da sie viele organische Stoffe gut lösen. Aus diesem Grund werden Ester häufig als Lösemittel in Lacken und Klebstoffen verarbeitet.
Versuch:
Nachweis von Lösungsmitteln in Lacken
IV. Ascorbinsäure
Ascorbinsäure ist auch unter dem Namen Vitamin C bekannt und kommt in Früchten
und Gemüse vor. Obwohl die Ascorbinsäuremoleküle keine Carboxylgruppen tragen,
ist sie in wässriger Lösung eine stark wirkende Säure, die pro Molekül
zwei Protonen abgeben kann. Diese stammen von zwei Hydroxygruppen, die jeweils an einem, durch
eine Doppelbindung untereinander verbundenen, Kohlenstoffatom hängen (Bild 4).
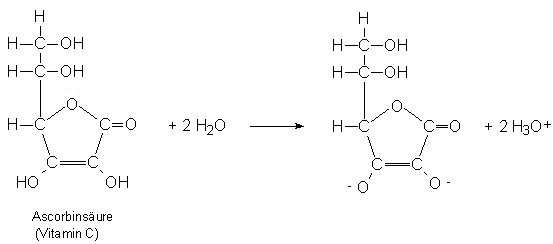
Bild 4: Reaktion von Ascorbinsäure mit Wasser
Neben der Eigenschaft als starke, organische Säure ist die Ascorbinsäure
ebenfalls ein starkes Reduktionsmittel und damit leicht zu oxidieren.
Versuche:
Saure Eigenschaften von Ascorbinsäure
Oxidation von Ascorbinsäure
Reduktionswirkung von Ascorbinsäure
Nachweis von Ascorbinsäure in Lebensmitteln
Weitere Texte zum Thema „Chemie im und ums Haus“