Prof. Blumes Tipp des Monats Januar 2003 (Tipp-Nr. 67)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.

(Foto: Blume)
Metalle reagieren mit Schwefel
Am Silvesterabend wurde wieder viel geknallt, und schöne Feuerwerksraketen stiegen in den Himmel. Was wäre ein Silvesterfest ohne Chemie? Als Grundstoff für die Knaller und für den Antrieb der Raketen spielt der Schwefel eine zentrale Rolle. Die bunten Flammenfarben werden durch das Verbrennen von Metallen und von Metallverbindungen herbeigezaubert. Kein Wunder, dass viele Kinder beim Begriff "Chemie" glänzende Augen bekommen.
Überhaupt zieht Kinder, die sich für Chemie interessieren, nichts anderes so magisch an wie die Beschäftigung mit Metallen und Schwefel. Und dazu reagieren diese Elemente noch miteinander - manche in prächtigen Reaktionen. Auch dabei kann man wieder viel über Chemie lernen.
Wir benötigen zunächst natürlich Schwefel, egal ob in Pulverform (durch Sublimation gewonnene "Schwefelblume" oder "Schwefelblüte") oder im Stück ("Stangenschwefel").
 |
| Bild 1: Schwefelblüte und Stangenschwefel
(Foto: Daggi) |
Dazu benötigen wir einige Metalle. Unverzichtbar sind Silber, Kupfer, Eisen, Zink und
(mit Bedenken) Magnesium. Und in dieser Reihenfolge wollen wir die Metalle mit
Schwefel reagieren lassen.
|
Versuch 1: Silber und Schwefel Schülerversuch In einem Reagenzglas erhitzen wir Schwefel, bis er kocht. Dann werfen wir ein längliches, nicht zu kleines Silberblech hinein. (Hallo Kinder: Ja nicht Muttis Schmuck nehmen!) Wir kochen noch ein wenig weiter und achten dabei darauf, dass das Reagenzglas nicht überkocht. Das Glas halten wir schräg mit der Mündung von der Gasflamme weg, damit sich der Schwefeldampf nicht entzündet. (Wenn das passieren sollte, ist es auch nicht schlimm. Wir löschen den Schwefelbrand im Reagenzglas, indem wir die Luftzufuhr abschneiden - etwa mit einem Korken.) Dann gießen wir den überschüssigen Schwefel ab. |
Ist überhaupt etwas passiert? Wir haben eigentlich nichts gesehen, also keine spektakuläre Reaktion bemerkt. Das Silberblech scheint noch erhalten zu sein, auch wenn es uns nicht gerade anstrahlt. Aber das wissen wir ja: Silber läuft in Gegenwart von Schwefel an. (Schließlich isst man mit einem Silberlöffel keine Eier!) Wenn wir jedoch nach dem Abkühlen (Vorsicht, das dauert lange!) das Glas vorsichtig zerschlagen haben und das Blech herauslösen, bemerken wir, dass es sich verändert hat: Aus dem blanken, verformbaren Silber ist ein neuer Stoff entstanden, der matt grau gefärbt und brüchig ist: Silbersulfid.
 |
| Bild 2: Silberblech und Silbersulfid
(Foto: Daggi) |
Das Silbersulfid bewahren wir auf, da wir es noch für Versuch 5 gebrauchen. Vorher reinigen wir es
aber vorsichtig und möglichst gut von anhängenden Schwefelresten.
Nun setzen wir Kupfer mit Schwefel um. Hier ist die Vorschrift:
|
Versuch 2: Kupfer und Schwefel Schülerversuch In einem Reagenzglas erhitzen wir wieder Schwefel bis zum Kochen. Dann werfen wir
ein 10 cm langes, blankes Kupferblech hinein. Den Schwefel erhitzen wir weiter, da er sonst abkühlt.
Das Blech glüht tiefrot auf - eine prächtig anzuschauende Reaktion!
|
Auch hier ist aus dem Metall, aus dem zuvor roten, biegsamen Kupfer, ein schwarzglänzender, brüchiger Stoff entstanden: Kupfersulfid.
 |
| Bild 3: Reaktion zwischen Kupfer und Schwefel
(Foto: Daggi) |
Jetzt wollen wir die Reaktion zwischen Schwefel und Eisen untersuchen.
|
Versuch 3: Eisen und Schwefel Schülerversuch Mische genau 11,2 g Eisenpulver und 6,4 g feinzerriebenen Schwefel. Die darfst du beim Mischen nicht verreiben, denn die beiden Elemente reagieren schon dabei miteinander. Aus dem gleichen Grund darfst du die Mischung auch nicht zu lange aufbewahren. Sie ist aber eine Woche lang stabil. Fülle mit dieser Mischung ein Reagenzglas bis zu einem Viertel und erhitze die Mischung. Wenn die Reaktion beginnt, stellst du den Brenner weg. Du kannst aber auch so vorgehen: Schütte das Pulver auf eine feuerfeste Unterlage und
verteile es gleichmäßig etwa 1 cm hoch zu einem Kreis. Am besten verwendest du einen Hohldeckel
wie etwa den einer Teedose. Den füllst du mit dem Gemisch. Drücke die Masse möglichst fest zusammen.
|
| Klick mich an! |
 |
| Bildreihe 4: Reaktion zwischen Eisen und Schwefel im Reagenzglas
(Fotos: Daggi) |
 |
 |
 |
 |
 |
 |
| Bildreihe 5: Reaktion zwischen Eisen und Schwefel
(Fotos: Daggi) |
Auch hier ist ein schwarzer, brüchiger Körper entstanden: Eisensulfid.
Wenn du das Produkt mit einem Magneten prüfst, wirst du noch einen
Restmagnetismus feststellen; der ist aber wesentlich geringer als der des elementaren
Eisens. Offenbar ist nicht alles Eisen umgesetzt worden.
Wenn du das Eisensulfid mit Salzsäure übergießt, riecht es nach faulen Eiern: Es
entsteht Schwefelwasserstoff. Achtung: Schwefelwasserstoff
ist in höheren Konzentrationen giftig. Deshalb für gute Lüftung sorgen. (Zum Vergleich solltest
du auch Eisenspäne und Schwefel getrennt mit Säure übergießen. Dann riechst
du nichts. Aber auf keinen Fall die Eisen/Schwefel-Mischung mit Salzsäure übergießen; dann bildet sich
nämlich in einer komplizierten Redoxreaktion ebenfalls Schwefelwasserstoff!)
Und wie reagiert Zink mit Schwefel?
|
Versuch 4: Zink und Schwefel Demonstrationsversuch Mische genau 13 g Zinkpulver und 6,4 g feinzerriebenen Schwefel. Die darfst du (wie
schon beim Eisen) beim Mischen nicht verreiben, denn die beiden Elemente reagieren
schon dabei miteinander. Aus dem gleichen Grund darfst du die Mischung auch nicht
zu lange aufbewahren. Sie ist aber einige Tage lang stabil.
|
 |
| Bild 6: Prof. Blume zeigt die Reaktion zwischen Zink und Schwefel
(Foto: Daggi) |
Diesen Feuerball kennst du sicherlich von der Muppet-Show: Man sieht ihn im
Hintergrund, wenn der kleine Drache auftritt.
Das Reaktionsprodukt ist diesmal ein weißes Pulver: Zinksulfid. Daneben hat sich
aufgrund der Hitze auch Zinkoxid, das ebenfalls weiß ist, gebildet.
Nun zum Problemfall Magnesium. Das reagiert so heftig mit Schwefel, dass das nur etwas für experimentelle Könner ist. Also: Finger weg! Denn die Mischung explodiert beim Erhitzen, und dann sind deine Finger im wahrsten Sinne in Gefahr, abgerissen zu werden.
Was lernen wir aus den Versuchen?
Zunächst geht es um die Energie. Bei der Reaktion mit Eisen und Zink haben wir deutlich gesehen,
dass Energie freigesetzt wird. Das erkennen wir daran, dass die Mischung heiß wird und sogar zu glühen
anfängt. Wir sprechen von Reaktionsenergie oder auch Wärmetönung.
Wie war das aber beim Kupfer? Da mussten wir zunächst erwärmen, dann aber glühte das Metall deutlich auf.
Das sah so aus, als wenn wir eine gehemmte Reaktion erst "lostreten" mussten. Das ist wie bei einem Stein,
den wir einen Abhang hinunterrollen wollen. Der Vergleich ist gar nicht so schlecht. Wir sprechen vom
Aktivieren der Reaktion, die zugeführte Energie ist die Aktivierungsenergie.
Beim Eisen und Zink haben wir natürlich auch aktivieren müssen - nur ging das viel einfacher und ein
einmaliges Anstoßen genügte - beim Zink eher als beim Eisen.
Chemiker haben herausgefunden, dass die Sulfidbildung grundsätzlich mit Energiefreisetzung verbunden ist. Wir nennen solche Reaktionen exotherm. Das ist nicht immer leicht zu erkennen: Beim Silber mussten wir ständig aktivieren, damit sich genügend Silbersulfid bilden konnte. Solch ein langanhaltendes Aktivieren kann man leicht mit Zufuhr an Reaktionsenergie verwechseln. Chemische Vorgänge, die nur ablaufen, wenn wir Energie zuführen, nennen wir endotherme Reaktionen. Das entspricht den Anstrengungen, einen Stein den Abhang hinaufrollen. Beim Zerlegen von Silbersulfid in Versuch 5 haben wir diesen Fall.
Wir können nun für die Sulfidbildung ein allgemeines Reaktionsschema angeben:
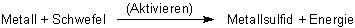
Die Reaktionsschemata und die Reaktionsgleichungen für diesen Tipp haben wir auf einer Extra-Webseite zusammengefasst.
Anhand unserer Versuchsergebnisse können wir sogar ein Ordnungsschema für Metalle aufstellen. Günter Jauch würde sagen: "Ordnen Sie die folgenden Metalle entsprechend ihrer Reaktionsenergie. Fangen Sie mit der niedrigsten Energie an." Hier ist das Ergebnis.
Silber < Kupfer < Eisen < Zink < Magnesium
Die Reihe hättet ihr nach den Versuchen auch hinschreiben können.
Umgekehrt ist es mit der Aktivierungsenergie: Je größer die freigesetzte Reaktionsenergie ist, desto geringer ist die aufzuwendende Aktivierungsenergie.
Diese Reihe kennen wir vielleicht schon von der Oxidation mit Sauerstoff her. In dieser Reihe
nimmt der edle Charakter der Metalle ab.
Wegen der Ähnlichkeit mit der Reaktion von Metallen mit Sauerstoff ordnet man auch
die Reaktion der Metalle mit Schwefel unter dem Überbegriff Oxidation ein.
Kann man Sulfide (wie auch einige Oxide) durch Erhitzen
wieder zerlegen, also reduzieren?
Bei den Oxiden der von uns eingesetzten Metalle gelingt diese so genannte thermische Reduktion nur
mit dem schwach gebundenen Silberoxid. Es geht auch mit dem umweltschädigenden Quecksilberoxid -
damit haben sich Generationen von Chemielehrern vergiftet - genau genommen nicht nur sich, sondern
sicherlich auch (wenn auch in geringerem Umfang) ihre Schüler. Thermische Zersetzung (Reduktion)
beobachten wir auch bei den Sulfiden, von denen ebenfalls nur das Silbersulfid (und natürlich auch das
Quecksilbersulfid) zersetzt werden kann.
|
Versuch 5: Zersetzen von Silbersulfid Schülerversuch In einem Reagenzglas erhitzen wir ein Stück von unserem in Versuch 1 hergestellten Silbersulfid. Zunächst passiert nichts; dann wird schlagartig eine große Menge Schwefel frei, der sich an der Wand des Reagenzglases niederschlägt (genau: sublimiert). Erhitze kräftig weiter; das "Blech" wird zu einem Silbertropfen. |
 |
| Bild 7: Thermische Zersetzung von Silbersulfid (Foto: Daggi) |
Das Reaktionsschema formulieren wir, indem wir die Gleichung zu Versuch 1
einfach umdrehen.
Silbersulfid + Energie ———> Silber + Schwefel
Ag2S + Energie ———> 2 Ag + S
Wir haben hier ein Beispiel für eine umkehrbare Reaktion entdeckt. In diesem Fall ist sie (anders als die entgegengesetzt verlaufende exotherme Sulfidbildung) eine endotherme Reaktion, die aber auch aktiviert werden muss. Das erkennst du daran, dass sich zu Beginn erst gar nichts tat, dann aber plötzlich der Schwefel freigesetzt wurde.
Das Tolle bei den Versuchen mit Silber, Schwefel und Silbersulfid ist, dass man mit ihnen die Umkehrbarkeit von Reaktionen gut zeigen kann. Das gilt auch für den Energieaustausch und die Rolle der Aktivierungsenergie. Beim analogen Silberoxid gelingt die direkte Herstellung des Oxids aus den Elementen leider nicht. Dazu ist ein wesentlich größerer Aufwand nötig (-> Versuch).
Beim Erhitzen der Sulfide von Metallen, die unedler sind als Silber, bilden sich in der Hitze in Gegenwart von Luftsauerstoff vor allem Schwefeldioxid und die zugehörigen Metalloxide.
Gibt es aber nicht ein natürliches Eisensulfid, Pyrit FeS2, das beim Erhitzen Schwefel freisetzt (-> Versuch)? Stimmt, aber der Pyrit ist kein einfaches Sulfid, sondern genau genommen ein schwefelreiches Disulfid, das beim Erhitzen zunächst Schwefel abgibt. Die Zersetzung ist also eine andere Reaktion als die thermische Reduktion von Silbersulfid.
Pyrit + Energie ———> Eisensulfid + Schwefel
FeS2 + Energie ———> FeS + S
(Für Spezialisten sei angemerkt: Es handelt sich um eine Disproportionierungsreaktion des Schwefels.)
Wir sehen, dass intermediär das uns schon aus Versuch 3 bekannte Eisensulfid entsteht. Das wird bei stärkerem Erhitzen in der Gegenwart von Luft in rotes Eisenoxid umgewandelt.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 14. August 2008, Dagmar Wiechoczek