Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Oktober 2016 (Tipp-Nr. 232)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Der Ort der Varusschlacht oder was Phosphate im Boden verraten können
Sabine Streller
Bild 1: Hermannsdenkmal
Mit dem Hermannsdenkmal im Teutoburger Wald wird an die große Schlacht im Jahre 9 n. Chr. erinnert, in der Hermann – oder Arminius, der Cherusker – drei römische Legionen unter Führung des Feldherren Varus vernichtend schlug und damit eine Ausbreitung des Römischen Reiches nach Germanien verhinderte. Bis zum Ende der 1980er Jahre lernten wir im Geschichtsunterricht noch die Zahl 9 n. Chr. mit der „Schlacht im Teutoburger Wald“ gleichzusetzten. Dabei war gar nicht gesichert, wo genau die Schlacht wirklich stattgefunden hat:
„Die Suche konzentrierte sich auf das östliche Sauerland, das südöstliche Münsterland, den Detmolder Raum, also den Teutoburger Wald, und das lippische Bergland bis zur Weser. »700 Theorien – doch keine führt zum Schlachtfeld« – fasste der westfälische Archäologe Wilhelm Winkelmann 1983 den Forschungsstand zusammen“ [1]. 1987 begann ein Major der im Landkreis Osnabrück stationierten britischen Armee den Funden von römischen Silbermünzen im Kalkrieser Raum nachzugehen; im Jahr darauf konnte er mit Funden von Teilen römischer Waffen nachweisen, dass am Fuße des Wiehengebirges römische Truppen gewesen sein müssen [1]. 1989 begannen die systematischen, archäologischen Ausgrabungen und Bodenuntersuchungen. Viele Funde und weitere Indizien ließen vermuten, dass der Ort der Varusschlacht in Kalkriese zu finden ist, und so wurde 2002 ein Museum mit großem Museumspark in Kalkriese zur Erinnerung an die Varusschlacht eröffnet. In der Dauerausstellung des Museums findet man neben vielen Funden, historischen Einblicken, Modellen und Videoinstallationen auch Kolben mit einer gelblichen Flüssigkeit und dem Begleittext, dass Bodenuntersuchungen auf Phosphat ein Indiz geliefert hätten, den Ort der Schlacht hier zu vermuten, denn Leichen würden nicht verschwinden… Klick mich an! Bild 2: Exponat in der Dauerausstellung Museum Kalkriese
Nicht sämtliches Phosphat, was von Tier und Mensch mit der Nahrung aufgenommen wird, kann auch verwertet werden und wird ausgeschieden. Da auch viele Abbauprodukte des Stoffwechsels phosphathaltig sind, enthalten Exkremente große Mengen Phosphor. So geht ein Teil der heutigen Phosphatlager auf Ablagerungen von tierischen Ausscheidungen und Anhäufung von Tierleichen zurück. Noch heute baut man solche Ablagerungen, die aus dem Kot von Seevögeln, wie Pinguinen, Kormoranen oder Tölpeln in Reaktion mit Kalk entstehen, auf Inseln als so genanntes Guano ab und vertreibt es als Phosphat- und Stickstoffdünger [2]. Aber auch Urin enthält Phosphate: Das „Phosphorsalz“ Natriumammoniumhydrogenphosphat NaNH4HPO4 · 4 H2O wird täglich in Grammmengen ausgeschieden [2]. (1) Ca3(PO4)2 + 6 HNO3 → 3 Ca(NO3)2 + 2 H3PO4 Nach dieser Behandlung sollten alle Phosphate in löslicher Form vorliegen. Mit salpetersaurer Vanadat-Molybdat-Lösung regieren die Phosphate zu einem gelben, stabilen Farbkomplex – genau dieser ist auch in der Ausstellung gezeigt (vgl. Bild 2). Je intensiver die Farbe, desto höher die Konzentration an Phosphat. In saurer Lösung bilden Molybdate unter Wasserabspaltung Polymolybdate, deren Polyanionen aus verknüpften Oktaedern aufgebaut sind. In Gegenwart von Phosphat-Ionen entsteht ein Heteropolysäuren-Komplex, der gelb gefärbt ist. In dem findet sich ein zentrales Phosphat-Ion von Polysäureanionen-Oktaedern umgeben. Gleiches gilt für Vanadat-Ionen. Der Zusatz von Vanadat zur Molybdatlösung sorgt zudem für eine deutliche Vertiefung der gelben Färbung. Die Gesamtreaktion kann durch folgende Gleichung vereinfacht dargestellt werden: (2) PO43- + 2 VO3- + 10 MoO42- + 10 H2O → [PV2Mo10O40]5- + 20 OH- Die Menge der gebildeten Heteropolyverbindungen ist proportional zur Konzentration des Phosphat-Ions. Der Farbkomplex kann deshalb gegen Vergleichsproben kolorimetrisch oder fotometrisch bestimmt werden. Die Vanadat-Molybdat-Methode eignet sich gut zur Bestimmung von Phosphat im Konzentrationsbereich von 0-80 mg/l. Versuch 1: Ansetzen einer Verdünnungsreihe für die Phosphatbestimmung mit der Vanadat-Molybdat-Methode 1. Herstellung einer Phosphatstammlösung (c = 100 mg/l)
0,1g PO4 soll also in einem Liter Wasser enthalten sein. Diese Masse wird dividiert durch die molare Masse von PO4 (M = 94,97 g/mol); man erhält als Ergebnis die Stoffmenge von 0,00105 mol. Die Stoffmenge wird nun multipliziert mit der molaren Masse von KH2PO4 (M = 136,07 g/mol). Die in einen 1-l-Maßkolben einzuwiegende Menge beträgt also 0,1433 g Kaliumdihydrogenphosphat. 2. Herstellung der Reagenzlösungen: Lösung A: Verdünnte Salpetersäure (Xi): 200 ml Wasser werden mit 100 ml konz. Salpetersäure (HNO3) (C) gemischt. Lösung B: Vanadatreagenz (Xi): 2,5 g Ammoniumvanadat (NH4VO3) werden in 500 ml Wasser gelöst, in einen 1-l-Maßkolben überführt, mit 20 ml konz. HNO3 (C) versetzt und mit Wasser auf 1 l aufgefüllt. Lösung C: Molybdatreagenz (Xi): 50 g Ammoniumheptamolybdat (NH4)6Mo7O24 · 4 H2O werden in 700 ml Wasser gelöst, in einen 1-l-Maßkolben überführt und mit Wasser auf 1 l aufgefüllt. 3. Ansetzen der Verdünnungsreihe:

(Foto: Blume)
(Foto: H. Pentermann; mit freundlicher Genehmigung des Museum und Park Kalkriese)
Was hat es mit Phosphat und Leichen eigentlich auf sich?
Phosphate sind Salze der Phosphorsäure. Das Element Phosphor steht mit 0,1 Gewichtsprozent in der Bio- und Lithosphäre an Stelle 13 der Elementhäufigkeit. Die wichtigsten natürlichen Mineralphosphate sind Calciumphosphate: Der Apatit Ca5(PO4)3(OH,F,Cl) und als Verwitterungsprodukt von Apatitgesteinen sowie organisch gebundenen Phosphats der Phosphorit Ca3(PO4)2. Das Mineral Hydroxylapatit Ca5(PO4)3(OH) (= 3 Ca3(PO4)2 · Ca(OH)2 ist wesentlicher Bestandteil der Zähne und Knochen von Wirbeltieren [2]. Jeder Mensch enthält in seinem Körper ungefähr 700 g Phosphor und benötigt wegen der Ausscheidung täglich ca. 800 mg [3]. 85 % des Phosphats im Körper sind im Knochen als Hydroxylapatit gebunden, 14 % liegen in weichen Geweben vor und 1 % befindet sich in der extrazellulären Flüssigkeit [3]. Generell ist das Phosphat in lebenden pflanzlichen und tierischen Organismen von besonderer Bedeutung im Stoffwechsel. In Form von Phosphorsäureestern spielt es eine bedeutende Rolle in der Fotosynthese [4] und der Glykolyse, in der Gen- und Proteinsynthese sowie der Energieübertragung. Besonders als Energiespeicher und -lieferant ist das Adenosintriphosphat (ATP) bedeutsam und ermöglich erst den Ablauf zahlreicher Stoffwechselvorgänge. Allein 50 kg (!) ATP baut ein Mensch täglich auf und wieder ab [5]. Und da alle Lebewesen größere Mengen Phosphat enthalten müssen, nehmen wir natürlich mit der Nahrung auch immer Phosphate zu uns. Wenn wir allerdings auf unseren Phosphatbedarf achten müssen, sollten wir phosphatarme und phosphatreiche Lebensmittel kennen.
Was kann denn Phosphat über den Ort einer Schlacht verraten?
Leben an einem Ort viele Menschen – einige Tausend sogar – in Zeltlagern, so werden die Exkremente und Nahrungsmittelreste der Menschen und der Tiere an diesem Ort verbleiben und so den Boden mit Phosphat anreichern, und zwar mehr als dies auf den umliegenden Böden der Fall ist. So lassen sich durch Bodenanalysen Gebiete mit erhöhtem Phosphatgehalt von anderen Gebieten abgrenzen. Fand an diesem Ort nun auch noch eine Schlacht statt, wird es viele tote Körper gegeben haben, die ebenfalls in diesem Gebiet verblieben sind. Die Zersetzung toten Materials führt ebenfalls zu einer Anreicherung des Bodens mit Phosphat.
Inwieweit kann die Phosphatanalytik helfen, historische Orte aufzuspüren?
Von Mitte 1994 bis 2000 fanden Suchgrabungen im Rahmen der archäologischen Erforschung der Varusschlacht in der Kalkrieser-Niewedder Senke statt; begleitet wurde diese Erforschung von bodenkundlichen und geologischen Untersuchungen [6]. Die Funde der archäologischen Untersuchungen konnten auf römisch-germanische Kampfhandlungen zurückgeführt werden und dieses Kampfgeschehen mit der Varusschlacht 9. n. Chr. gleichgesetzt werden. Bodenkundliche Begleituntersuchungen ergänzen Suchgrabungen sinnvoll, da der Boden, der die Fundstücke umgibt, wertvolle weitere Hinweise liefern kann. Und da Phosphat in Gegensatz zu anderen Anionen sehr stabil im Boden lagert und insbesondere die schwerlöslichen Phosphate durch Wasser kaum ausgewaschen werden, sind auch 2000 Jahre nach einem Ereignis gute Ergebnisse zu erwarten.
Wie bekommt man Phosphat aus dem Boden freigesetzt, wenn es doch fest gebunden wird?
Die Bestimmung des Gesamtphosphats erfolgte in den archäologischen Untersuchungen in Kalkriese in Anlehnung an die Methode von R. D. Bleck [7]. Dazu wird absolut trockener Feinboden genau eingewogen, im Muffelofen bei 800°C geglüht und anschließend mit Salpetersäure zum Sieden erhitzt. Die Bodenprobe wird damit „aufgeschlossen“, unlösliches Phosphats wird in lösliches überführt. Dabei reagiert der Calciumphosphatanteil des Apatits mit Salpetersäure:
Zunächst wird berechnet, wieviel gut wasserlösliches Kaliumdihydrogenphosphat (KH2PO4) eingewogen werden muss:
In 10 Maßkolben von je 100 ml werden exakte Mengen der Phosphatstammlösung nach dem folgenden Schema pipettiert, diese anschließend mit je 10 ml der Reagenzlösungen A, B und C versetzt und auf 100 ml aufgefüllt.
Konzentration PO4 (mg/l)
0
2
4
7
10
20
30
40
60
70
Stammlösung in ml
0
2
4
7
10
20
30
40
60
70
Klick mich an!
Bild 3: Phosphatbestimmung mit der Vanadat-Molybdat-Methode – Verdünnungsreihe (hier bereits in Erlenmeyerkolben umgefüllt)
(Foto: S. Streller)
Für die Untersuchung liegen Bodenproben vor, die entnommen wurden aus
1) einem dreimal im Jahr mit organischem Dünger versorgten Kürbisbeet (Probe 1),
2) einer Ecke des Nachbargartens, in der zwei Kaninchen sowie mehrere tote Vögel begraben wurden (Probe 2) und
3) einem Beet des nur im zeitigen Frühjahrs gedüngten Nachbargartens (Probe 3).
Versuch 2: Phosphatbestimmung von Bodenproben mit der Vanadat-Molybdat-Methode
1. Aufschluss der Bodenproben
Die Bodenproben werden zunächst gesiebt, um größere Pflanzenteile zu entfernen, und bei 105 °C eine Stunde im Trockenschrank getrocknet. Anschließend werden zwischen 8 und 12 Gramm der Probe in einen Porzellantiegel eingewogen, notiert (die Masse des Tiegels muss ebenfalls notiert werden!) und bei 800°C für 2 Stunden im Muffelofen geglüht.
Klick mich an!
Bild 4: Bodenproben 1, 2 und 3
Unten Originalprobe, Mitte gesiebte Proben, oben geglühte Proben
(Foto: S. Streller)
Die geglühten Proben müssen nach dem Abkühlen erneut gewogen werden, um den für die Auswertung wichtigen Glühverlust der Bodenprobe zu ermitteln. (Zur Anwendung der Glühverlustwerte siehe weiter unten).
| Probe 1 | Probe 2 | Probe 3 | |
|---|---|---|---|
| Einwaage in g | 10,644 | 12,453 | 12,029 |
| m nach dem Glühen in g | 9,894 | 11,911 | 11,528 |
| Glühverlust in g | 0,75 | 0,542 | 0,501 |
| Glühverlust in % | 7,05 | 4,35 | 4,16 |
Von den geglühten Proben werden anschließend jeweils exakt 2 g in je ein 100-ml-Becherglas eingewogen und mit 10 ml verdünnter Salpetersäure (Lösung A) versetzt. Mit einem Uhrglas abgedeckt, wird die Mischung bis zum Sieden erhitzt und dann langsam abgekühlt.
Zur Vorbereitung der Filtration wird das Filterpapier im Trichter gut mit dest. Wasser gespült. Dann wird die Aufschluss-Suspension vorsichtig in einen 100-ml-Maßkolben filtriert. Das Becherglas und der Filterkuchen werden zum Schluss gut mit dest. Wasser gespült; das Spülwasser wird ebenfalls in den Maßkolben filtriert.
Achtung: Da in den Kolben noch je 10 ml der Reagenzlösungen B und C gefüllt gegeben werden müssen, empfiehlt es sich, zum Spülen mehrere kleine Volumina Wasser zu verwenden und dabei den Kolben nicht zu sehr zu füllen.
Nun werden in die Kolben je 10 ml der Vanadat- und Molybdatlösung (Lösung B und C) pipettiert und mit dest. Wasser auf 100 ml aufgefüllt. Nach ca. 20 Minuten ist die Farbreaktion abgeschlossen.
Auswertung der Bodenuntersuchungen
Zur Auswertung der Phosphat-Bestimmung gibt es zwei Methoden, eine subjektive und eine objektive. Erstere ist die kolorimetrische Bestimmung, die andere ist die fotometrische oder apparative Bestimmung.
1. Kolorimetrische Bestimmung
Hierbei werden die Bodenproben mit der Standard-Verdünnungsreihe optisch („mit dem Auge“) verglichen.
Klick mich an!
Bild 5: Vergleich des Phosphatgehaltes der Bodenproben mit Standards der Verdünnungsreihe
Ergebnis: Die Bestimmung mit dem Auge hat sich viel schwieriger gestaltet, als zunächst angenommen. Da die Verdünnungsreihe einen deutlichen Farbverlauf zeigt, hatten wir angenommen, die Proben gut einsortieren zu können. Jedoch haben verschiedene Faktoren, wie die Eigenfarbe des Kolbenglases, die unterschiedliche Dicke der Kolben und auch Reflexionen durch den Lichteinfall einen sicheren Farbvergleich nahezu unmöglich gemacht. Aus diesem Grund haben wir uns für eine standardisierte Methode entschieden und eine fotometrische Messung angeschlossen.
2. Fotometrische Bestimmung
Vom Blindwert und allen Proben der Verdünnungsreihe wird die Absorption bzw. die Extinktion mit einem Fotometer bei einer Wellenlänge von 430 nm gemessen. Als Blindwert bzw. Referenz dient eine Mischung aus je 10 ml der Lösungen A, B und C, die mit destilliertem Wasser auf 100 ml aufgefüllt wurde.
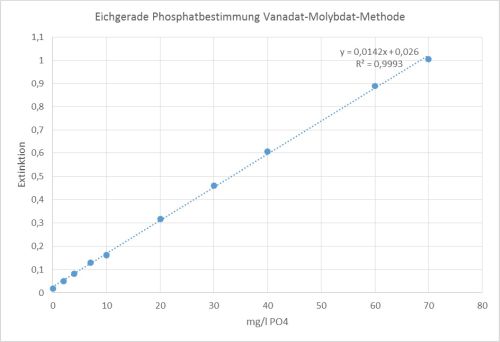
Die Extinktionswerte werden gegen die Konzentration mit Hilfe des Programms Excel in einem Diagramm aufgetragen und die Ausgleichsgerade berechnet. Nun können die Konzentrationen der Proben graphisch oder rechnerisch ermittelt werden.
Klick mich an!
Die Messungen haben für die Proben folgende Phosphatkonzentrationen ergeben:
| Probe 1 | Probe 2 | Probe 3 | |
|---|---|---|---|
| Extinktion | 0,988 | 0,636 | 0,597 |
| Phosphatkonzentration (mg/l) | 67,75 | 42,96 | 40,21 |
Mit der fotometrischen Bestimmung konnten im Gegensatz zur kolorimetrischen deutliche Konzentrationsunterschiede aufgezeigt werden. Um den realen Phosphatgehalt in den originalen Bodenproben berechnen zu können, muss der Glühverlust berücksichtigt werden.
| Probe 1 | Probe 2 | Probe 3 | |
|---|---|---|---|
| Glühverlust in % | 7,05 | 4,35 | 4,16 |
Rechenbeispiel für die Probe 1:
Die Messung ergab eine PO4-Konzentration von 67,75 mg/l, das entspricht 6,775 mg in 100 ml. Da in dem 100-ml-Maßkolben der Aufschluss aus 2 g geglühtem Boden der Probe 1 enthalten war, haben diese 2 g also einen Phosphatanteil von 6,775 mg. Unter Berücksichtigung des Glühverlustes von 7,05 % enthalten 2,141 g des trockenen Bodens diese 6,775 mg PO4. Um den Phosphatgehalt nun wie üblich in mg P pro kg Boden anzugeben, ermitteln wir zunächst die Masse PO4 in einem Kilogramm Boden mit dem Dreisatz:
6,775 mg / 2,141g = x / 1000g
x = 3164,4 mg PO4
Um ausschließlich den Anteil des Elementes Phosphor zu ermitteln, müssen wir die Masse x zunächst gemäß n = m/M durch die molare Masse von PO4 (94,97 g/mol) dividieren (n = 33,32 mol) und dann mit der molaren Masse von P (30,97 g/mol) multiplizieren: 1032 mg P befinden in einem kg Boden der Probe 1.
| Probe 1 | Probe 2 | Probe 3 | |
|---|---|---|---|
| mg P / kg Boden | 1032 | 671 | 629 |
Was sagt uns nun der Phosphatgehalt der untersuchten Bodenproben?
In jedem Falle zeigen alle drei Bodenproben relativ hohe Phosphatgehalte und deuten auf intensive Bodennutzung hin [6]. Das gilt in besonderem Maße für das gut gedüngte Kürbisbeet (Probe 1). In dem weniger gedüngten Garten (Probe 3) zeigen die Ergebnisse einen ebenfalls recht hohen Phosphatgehalt jedoch ist er niedriger als in dem Boden, in dem einige tote Tiere vergraben wurden (Probe 2). Der Unterschied zwischen den Proben 2 und 3 ist aber nicht groß, so dass wir diese Ergebnisse mit aller Vorsicht bewerten wollen. Um an dieser Stelle verlässliche Werte zu erhalten, müssten mehrere Proben in exakten Tiefen der Böden entnommen werden. Auch ist daran zu denken, bei den Bodenproben ein enges Oberflächenraster zu verwenden. So sollte die Probe 2 direkt vom Ort der Tierleichen-Bestattung entnommen werden, da das Phosphat im Boden fest gebunden ist und kaum wandert. Da können schon einige Zentimeter Abstand für große Konzentrationsunterschiede sorgen.
Welche Ergebnisse mit der Phosphatmethode wurden in Kalkriese gefunden?
Die Untersuchungen der Böden im Gebiet Kalkriese haben gezeigt, dass die Böden dort Phosphor-Gehalte von 100 mg bis 600 mg P/kg Boden aufweisen [6]. Diese Befunde sind nicht besonders eindeutig, um den Ort der Varusschlacht zu identifizieren, denn sie deuten eher auf eine intensive landwirtschaftliche Nutzung in den zurückliegenden hunderten Jahren hin. Insbesondere die Ergebnisse der Analysen im angrenzenden Bergland zeigen erhöhte Phosphatgehalte (> 800 mg P/kg Boden), die als Merkmale der sogenannten Eschwirtschaft anzusehen sind [6]. Unter der Eschwirtschaft versteht man eine alte Landwirtschaftsform, die vor allem in Norddeutschland und den Niederlanden üblich war. Der Esch war ein Stück Ackerland, das nah ans Haus angrenzte und meist etwas höhergelegen war. Dieses Ackerland wurde gedüngt, indem Bodenstücke aus dem Wald oder der Heide – sogenannte Plaggen – zunächst im Stall als Einstreu verwendet, dann kompostiert und anschließend auf den Esch aufgebracht wurden. Durch das Tränken der Plaggen mit den Exkrementen der Tiere waren die so geplaggten Böden besonders reich an Phosphat.
Letztlich konnten die Phosphatanalysen in Kalkriese keine zuverlässigen Hinweise auf den Ort der Schlacht liefern, da die landwirtschaftlichen Aktivitäten, durch die viel phosphathaltiger Dünger in den Boden eingetragen wurde, die archäologischen Funde überformt hat [6]. Nichtsdestotrotz sprechen die Phosphatuntersuchungen aber auch nicht gegen den Ort der Schlacht.
Der wahre Ort der Varusschlacht bleibt also weiterhin ein Geheimnis und deshalb ein heiß diskutiertes Thema…
Literatur:
[1] http://www.kalkriese-varusschlacht.de/varusschlacht/die-suche-nach-dem-ort/ (Zugriff 02.09.2016; 11:29)
[2] A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie, Walter de Gruyter, Berlin, New York, 1995, 101. Auflage, S. 725f./774.
[3] R. Klinke, H.-C. Pape, S. Silbernagel: Physiologie, Thieme Verlag, Stuttgart, 5. Auflage, S. 399/474.
[4] S. Streller, K. Roth: Mein kleiner grüner Kaktus. Chemie in unserer Zeit, 44 (4), 284-305.
[5] P. Schopfer, A. Brennicke: Pflanzenphysiologie. Spektrum Verlag, 6. Aufl. 2005
[6] J. Harnecker, E. Tolksdorf-Lienemann: Kalkriese 2. Sondierungen in der Kalkrieser-Niewedder Senke. Archäologie und Bodenkunde, Verlag Philipp von Zabern, Mainz, 2004.
[7] R. D. Bleck: Zur Durchführung der Phosphatmethode. Ausgrabungen und Funde 10, Berlin, 1965, S. 213 -218.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 30. September 2016, Fritz Meiners