 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1746
F: Warum schmecken verdorbene Milchprodukte heute nicht mehr wie früher sauer, sondern bitter?
A: Hierzu haben wir eine Webseite.
1747
F: Ich habe mir feinen Rotwein (Portugieser) auf das weiße Poloshirt gekippt und den roten
Fleck gleich mit Seife heraus waschen wollen. Raus ist er nicht, jetzt ist er aber graublau geworden. Warum? Was kann ich tun?
A: Die roten Farbstoffe des Weins sind Anthocyane.
Sie verhalten sich wie die Farbstoffe im Rotkohlsaft. Wein enthält - auch wenn man es wegen
seiner Süße nicht so richtig schmeckt - eine Menge Säuren. Im sauren Milieu sind die Farbstoffe rot.
Die Seife dagegen reagiert neutral bis schwach alkalisch. (Klicke hier.) Im Neutralen bis schwach Alkalischen sind die Farbstoffe violett bis blau.
Hier nützt nur noch peroxidhaltiges Fleckensalz. Dann müssen Sie alles gut auswaschen. Am besten soll es mit enzymhaltigen Waschmitteln gehen.
1748
F: Worauf beruht es, dass man durch Salzbestreuen Rotweinflecken entfernen kann?
A: Hierzu haben wir eine Webseite.
1749
F: Ich arbeite gerade an einem Artikel zum Thema Kohle für eine Schulzeitschrift, dem ich
auch einen Versuch beistellen möchte. Bei der Recherche für ein Grundschul-gemäßes Kohle-Experiment bin ich auf die Idee mit dem
gefärbten Wasser (entweder Tinte oder Lebensmittelfarbe aus aufgelösten Smarties) und der Kohletablette gestoßen. Damit kann man
die Filtereigenschaft der Kohle zeigen. Man muss das gefärbte Wasser, nachdem sich darin die Kohletablette aufgelöst hat, durch
einen Kaffeefilter gießen und dann soll klares, farbloses Wasser unten herauskommen. Tut es aber nicht. Ich hab´s auch mit Himbeersaft
probiert, weil ich wissen wollte, ob auch der Geschmack verloren geht. Das funktioniert noch weniger. Können Sie mir sagen, was ich
falsch mache? Oder hätten Sie eine bessere Experimentidee? In dem Artikel geht es um den Rohstoff Kohle allgemein: wo sie herkommt,
wie sie entstanden ist, welche Formen wir kennen und wozu wir heute Kohle brauchen.
Das Experiment sollten Kinder zwischen acht und zehn Jahren ohne Gefahr alleine durchführen können. Notwendige Materialien sollten in jedem Haushalt vorhanden sein.
A: Ich gehe davon aus, dass Ihre Aktivkohle in Ordnung ist, dass Sie diese aus einem
verschlossenen Tabletten-Blister entnommen haben. Und dass Sie nicht zu sparsam mit der Aktivkohle umgegangen sind...
Die Aktivkohle adsorbiert nur solche Stoffe, die - wie Fachleute sagen - unpolar oder wenig polar sind. Polare Stoffe sind wasserlöslich, unpolare weniger oder gar nicht. Lebensmittelfarbstoffe jedoch müssen polar sein, damit sie problemlos mit dem Harnwasser ausgeschieden werden können. Deshalb haben Sie mit den wasserlöslichen Smarties-Farbstoffen keinen Erfolg.
Gleiches gilt für Blütenfarbstoffe oder blaue Tinte. Aber auch viele der Stoffe, die den typischen Himbeergeruch ausmachen, werden von der Aktivkohle nicht oder kaum adsorbiert, bleiben also nicht „hängen“.
Probieren Sie es mit roter Lehrertinte. Der Farbstoff heißt Eosin; er ist zwar ein wenig wasserlöslich, aber nicht zu polar. Nehmen Sie vor allem nicht zu wenig Aktivkohle, weil auch Eosin sich nicht allzu stark adsorbieren lässt. Sie können auch versuchen, mit Aktivkohle den Mineralölgeruch von verseuchtem Wasser zu entfernen. Das Wasser verseuchen Sie, indem Sie einen Tropfen Heizöl in einen Liter Leitungswasser geben und gut vermischen.
Zur Aktivkohle haben wir einen Grundschul-Versuch.
1750
F: Lieber Herr Professor Blume,
als Chemie-Lehrer hat man ab und zu Fragen, die auch die lieben Kollegen nicht schlüssig beantworten können.
Vor vielen Jahren habe ich folgenden spektakulären 'Knall-Versuch' bei der Behandlung der Halogenalkane durchgeführt:
ich ließ im Freien ein Reagenzglas, in das eine kleine Menge eines Eutektikums aus Na/K eingebracht war und auf das ich wenige
ml CCl4 fließen ließ, aus großer Höhe in einen Eimer fallen. Ich habe diesen Versuch lange nicht mehr gemacht. Nun las
ich im Internet 'irgendwo', dass dieser Versuch sehr gefährlich sei, da die Alkalimetalle auch gleich mit dem Halogenalkan reagieren
könnten.
Stimmt das? Oder geht es nur darum, kleine Mengen zu verwenden? Haben Sie oder Ihr Team damit Erfahrung?
Vielen Dank, wenn Sie sich Zeit nehmen könnten, mir zu antworten.
Mit exothermen Grüßen (...)
A: Dieser Versuch (früher ein Highlight in der Chefvorlesung, das aber aus gutem Grunde
ein Assistent vorführen musste) gilt wirklich als extrem gefährlich. Denn es kann auch schon beim Mischen zu einer Dichlorcarbenbildung
und Explosion kommen.
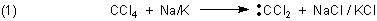
Dichlorcarben entsteht auch, wenn man konzentrierte Kali- oder Natronlauge auf Chloroform einwirken lässt. Deshalb darf man beide Substanzen auf keinen Fall mischen. Das zu wissen, ist für die Planung der Abfallentsorgung im chemischen Labor wichtig.
Dichlorcarben (ein Gas) ist äußerst gefährlich. Genau genommen handelt es sich um ein aliphatisches Kohlenstoffradikal. Denn das zweibindige C-Atom enthält zwei freie Elektronen, die letztlich eine Oktettlücke repräsentieren. Diese können einzeln vorliegen (Triplett-Carben) oder wie meistens bei den Chlorcarbenen als Elektronenpaar (Singulett-Carben).
Carbene reagieren mit Substanzen, die freie Elektronenpaare enthalten, z. B. mit Basen, aber auch mit Doppelbindungen, z. B. bei Alkenen oder Aromaten. Die entsprechenden Verbindungen können im Gefäß, das man benutzt, bereits vorhanden sein.
Aber Carbene reagieren in stark exothermer Reaktion auch mit sich selbst. Das kann einmal eine Disproportionierung sein:
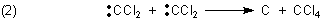
Es kann auch zur Bildung von langen Molekülketten kommen.
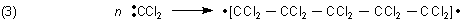
Diese Reaktionen sind gehemmt und benötigt ein Anstoßen (Aktivierung). Dazu diente im oben geschilderten Versuch das „Fallenlassen des Reagenzglases“. Leider kann aber auch schon ein Schütteln des Reagenzglases oder das Umrühren genauso wirken.
Lassen Sie deshalb die Finger davon, bevor Ihnen dieselben abgesprengt werden... Außerdem ist meines Erachtens nach der Umgang mit CCl4 in vielen Bereichen der Schule sowieso nicht mehr erlaubt.