 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1871
F: Ich schreibe zurzeit meine Seminararbeit über das Färben mit Brennnessel. Könnten Sie mir
sagen, welchen Farbstoff Brennnessel enthalten? Ist es das Chlorophyll? Leider finde ich dazu nichts im Internet und es gibt leider
auch keine Literatur darüber.
A: Es handelt sich um eine Farbstoffmischung, die die üblichen Farbstoffe von grünen
Blättern enthält: Chlorophylle (viel Chl a: blaugrün und weniger Chl b: gelbgrün), beide
sind recht empfindlich und werden durch Licht und Luft sowie Feuchtigkeit/Mikroorganismen nach und nach zerstört. Dazu kommen die
gelben bis orangefarbenen Xanthophylle. Es handelt sich um mit dem orangeroten Carotin verwandte
Farbstoffe („Carotinoide“).
Insgesamt reicht das Färbeergebnis von einem etwas gelblichen Grün bis zur „Schmuddelmischfarbe“ Braun. Das hängt auch davon ab, wie lange man die Brühe kocht, wie alt oder frisch die Blätter sind und so weiter. Aber auch das Material, aus dem der zu färbende Stoff besteht, ist für den Farbton wichtig.
1872
F: Zuerst einmal vielen herzlichen Dank für Ihre großartige Website, in der ich mir immer
wieder Inspiration für Versuche mit Schülern holen kann. Ich habe den Versuch " Citronensäure als Komplexbildner" ausprobiert und
er hat hervorragend funktioniert. Im Übrigen studiere ich Lehramt für das Gymnasium in den Fächern Biologie und Chemie an der
Universität Regensburg.
Nun zu meiner Frage: In der Versuchsbeschreibung geben Sie an, dass als Komplex zwischen der
Citronensäure und dem Kupfer(II)- Kation das [Cu(CitH)2]2- entsteht. Nun hat mich meine Dozentin bei der
Protokollierung dieses Versuchs darauf hingewiesen, dass in Anwesenheit von OH--Ionen andere stabile Komplexe entstehen
können. Die Zitierung einer Originalliteratur wäre hilfreich und nötig.
Können Sie mir bezüglich dieses Versuchs Literaturangaben (möglichst mit Seitenangabe) machen, welche ich nachschlagen und
zitieren könnte?
Ich habe es bereits selbst versucht, Literatur zu diesem Versuch zu finden, jedoch erfolglos. Sollten Sie mir weiterhelfen können,
währe ich Ihnen sehr dankbar.
A: Dieser Versuch ist mir schon lange bekannt. Literatur dazu in dem Sinne, wie Ihre Dozentin
es wünscht, kenne ich nicht.
Ihre Dozentin hat natürlich Recht. Aber sie liegt insofern auch nicht ganz richtig, weil sie auch an die anderen Anionen denken muss, die sich in die Reaktionsmischung tummeln könnten, wie Chlorid, Sulfat, Nitrat..., weil die sich durchaus als Bildner gemischt zusammengesetzter Komplexe hervortun können. Dann kommt es noch auf die exakte pH-Abhängigkeit der Komplexbildung an. Das ist eine Frage der eng beieinander liegenden pKa-Werte der Citronensäure.
Wenn Sie genauer nachsehen oder die Liganden identifizieren oder die Komplexbildungsmöglichkeiten zählen müssten, wäre das Stoff für eine (ziemlich sinnlose) Dissertation.
Ich weiß nicht, was Sie für eine Arbeit schreiben. Aber es sollte nicht in Erbsenzählerei ausarten. Als angehender Lehrer sollten Sie lernen, von solchen chemischen Feinheiten zu abstrahieren: Sie sollten sich vielmehr darüber Gedanken machen, wie man das Ergebnis den Schülern so aufbereitet, dass sie Spaß an der Chemie behalten. Dabei kann man natürlich auch die Vereinfachung diskutieren.
Kurz gesagt: Literatur ist mir dazu nicht bekannt. Ich vermute auch, dass es dazu gar nichts gibt, weil es keinen interessiert.
1873
F: Ich grüße Sie ganz herzlich und wünsche Ihnen für Ihren (Un-)Ruhestand alles Gute. Ich freue
mich sehr, dass sie weiterhin für uns ansprechbar sind.
Während der Praktikumszeit meiner Schüler /innen durchforste ich immer unsere Sammlung. In einer Kiste zum Thema "Kerzen ziehen/gießen" fand ich mehrere Plastiktüten mit Farbstoffen: Fettgrün, Fettgelb, Fettblau - wahrscheinlich die Trivialnamen. Ich nehme an, dass es Farbpigmente auf organischer Basis sind, die zum Färben von Kerzenwachs verwendet werden können. Leider finde ich in den bekannten Datenbanken (GISS) keine Infos, die ich zu einem Etikett und einem Stoffdatenblatt verarbeiten könnte. Der Inhalt ist wahrscheinlich weder giftig noch schädlich.
Ich würde mich freuen, wenn Sie mir zu diesen drei Stoffen etwas sagen könnten.
Ohne mehr Informationen werde ich sie doch zur Entsorgung geben.
A: Ihre Frage hat uns ganz schön beschäftigt, denn über diese Farbstoffklasse ist in der
moderneren Literatur nichts mehr zu finden. Im Internet findet man unter dem Stichwort Fettgrün nur die bekannte Pfadfinderauszeichnung.
Das alles ist ein Hinweis darauf, dass mit diesen Farbstoffen irgend etwas nicht stimmt.
Es handelt sich um Stoffe aus der Gruppe der Fettfarben, also Farben, die Fette, Öle und andere unpolare Substanzen wie u. a. auch Kerzenwachs und Kunststoffe anzufärben erlauben. Bei durchgefärbten Kerzen verwendet man z. B. Anilinfarben. Der Gehalt an Anilinfarbstoffen ist auch die Ursache dafür, dass gefärbte Kerzen beim Abbrennen immer chlorartig, das heißt nach Stickoxiden riechen. Klicke hier.
Im Allgemeinen handelt es sich bei den Fettfarben nach moderner Anschauung um giftige Substanzen, da viele im Verdacht stehen, cancerogen zu sein - wie das Sudanrot III oder Buttergelb. Fettblau Z ist zum Beispiel ein Phenylendiamin- oder meinetwegen auch Anilinderivat. Hier ist die Formel.
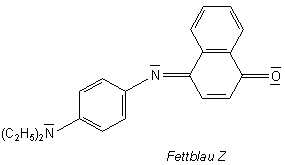
Man erkennt, dass Fettblau zu den Indophenolfarbstoffen gehört. Anders das ungiftige Tillmanns Reagenz (Nachweis von Ascorbinsäure) ist es jedoch nicht wasserlöslich. Es ist deshalb anzunehmen, dass es wie die Polykondensierten Aromaten (PAK) durch körpereigene Enzyme zur Vorbereitung der Ausscheidung über die Niere in cancerogenes Epoxid umgewandelt wird.
Somit gibt es für Sie nur eines: Die Farbstoffe vorschriftsmäßig in den organischen Sondermüll entsorgen.
Lit.: W. Kratzert, R. Peichert: Farbstoffe. Chemische Arbeitsbücher 1. Quelle & Meyer. Heidelberg 1981.
1874
F: In meinem Chemie-Seminar muss eine Gruppe, zu der ich gehöre, über Invertzucker Informationen
herausfinden. Zu den folgenden Fragen finde ich aber nach langer Suche einfach keine Antworten. Ich hoffe, Sie können sie beantworten.
- Warum die Zugabe von Invertzucker bei der Bonbonherstellung vorteilhafter ist als nur Zucker bzw. warum werden die Bonbons erst
durch Invertzucker geschmeidig?
Bonbonrezept:
300g Zucker
120ml Wasser
100g Invertzucker
Auf 142°C bringen, abkühlen lassen und kurz vorm Festwerden Aromen dazugeben
- Warum genau muss man diese Bonbonmischung auf 142 °C erhitzen? Was passiert chemisch?
- (Hier bin ich mir nicht sicher) Warum kristallisiert Invertzucker nicht so schnell (nach dem Abkühlen) wie Zucker?
A: Warum man die Mischung genau auf 142 °C erhitzen muss, weiß ich nicht. Aber vielleicht
hilft das Folgende weiter: Bonbons werden aus einem geschmeidigen „Strang“ geformt. Die Geschmeidigkeit hat den Vorteil, dass man
mit dem „Strang“ besser arbeiten kann als mit einer flüssigen Schmelze.
Wahrscheinlich ist, dass das die optimale Temperatur ist, bei der einerseits die Zuckermischung ausreichend weich und geschmeidig wird und noch nicht unter Flüssigkeitsbildung schmilzt, sich andererseits aber auch noch nicht zersetzt und braun wird.
Zu den anderen Fragen:
Dass die Bonbons mit Invertzucker geschmeidig werden, liegt daran, dass der schlecht kristallisiert. Invertzucker ist eine 1:1-Mischung
von Fructose und Glucose.
Meistens nimmt man statt „reinem“ Invertzucker „Glucose-Fructose-Sirup“, also Saccharose-Hydrolysat. Das enthält noch ca. 50 % nicht
hydrolysierte Saccharose. Es ist vergleichbar süß wie Saccharose und gilt als gesünder bzw. billiger. Hinzu kommt: Alle drei Zucker
hindern sich gegenseitig an der Kristallbildung. Deshalb verwendet man Invertzucker-Sirup auch als Grundlage für Cremes, die unter dem
Begriff „Kunsthonig“ bekannt sind.
Zur Literatur: Lesen Sie dazu z. B.
H.-D. Belitz, W. Grosch, P. Schieberle: Lehrbuch der Lebensmittelchemie; Springer-Verlag, 6. Auflage, Berlin Heidelberg New York 2008.
1875
F: Ich bin Referendar und möchte gerne im Biologieunterricht Blausäure in Kirschlorbeerblättern
nachweisen.
Allerdings müsste ich laut Schule eine Gefährdungsbeurteilung schreiben. Nun habe ich seit langem Suchen und weiteren Telefonaten
mit Giftzentralen nicht herausfinden können, wie viel Blausäure ein Blatt der Kirschlorbeere freisetzt.
Natürlich werden die Schüler darauf hingewiesen, dass die Blätter nicht zum Verzehr geeignet sind, aber dennoch möchte ich im
rechtlichen und gesundheitlichen Rahmen absichern, um potentielle Gefahren ausschließen zu können. Über eine Antwort freue ich mich sehr.
A: Sie meinen den Tipp des Monats Nr. 106. Mir liegen keine
HCN-Konzentrationswerte vor, aber Sie können damit ohne Bedenken arbeiten, denn die Konzentrationen der austretenden HCN sind relativ
gering. Probieren oder gar essen sollten Sie die Blätter und Früchte nicht (lassen). Aber die schmecken auch gar nicht so gut…
Es gibt nur wenige Pflanzen, die so toxisch sind, dass man eine Gefährdungsbeurteilung erstellen müsste. Selbst vom vielgescholtenen Goldregen verträgt man einiges, bevor man gesundheitlichen Ärger bekommt. Anders ist das bei der Tollkirsche, bei der der „Herzkasper“ relativ rasch einsetzt. Oder denken Sie an die Pilze. Einen Knollenblätterpilz würde ich nicht mit in den Unterricht bringen. Und wenn doch, dann würde ich ihn nicht herumreichen lassen.