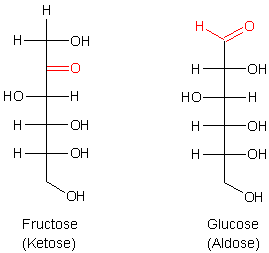
Die Lobry de Bruyn-van Ekenstein-Umlagerung
Experimente:
Versuch: Nachweis von Glucose und Fructose mit Fehling-Lösungen
Warum überhaupt reagiert Fructose mit Fehling-Lösungen?
Um Fehling-Lösungen rot zu färben, muss Cu(II) zu Cu(I) reduziert werden. Für
Kohlenhydrate bedeutet das, dass Aldehyd-Gruppen vorhanden sein müssen. Sie sind es,
die die Reduktion bewirken. Ein Fructosemolekül besitzt allerdings keine Aldehyd-Gruppe.
Wie kann es also zu einer solchen Rotfärbung kommen?

Wie alle Kohlenhydrate besteht Fructose aus einer Kohlenstoffkette, an der jedes C-Atom entweder mit einer Hydroxyl- oder Carbonylgruppe verbunden ist. Damit sind in einem Kohlenhydratmolekül sowohl die funktionelle Gruppe des Alkohols als auch die der Carbonyle vorhanden. Kohlenhydrate besitzen deshalb die Möglichkeit, sowohl wie Alkohole als auch wie Carbonylverbindungen zu reagieren. Beide Verbindungstypen stehen in einem besonderen Verhältnis zueinander, im Klartext: Sie können sich ohne äußere Hilfe ineinander umwandeln. Diese Eigenschaft nennt man Keto-Enol-Tautomerie.
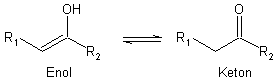
Zwischen beiden Formen stellt sich ein chemisches Gleichgewicht ein.
Diese Reaktion kann auch in Kohlenhydraten ablaufen. Diese Umlagerung nennt man etwas umständlich Lobry de Bruyn-van Ekenstein-Umlagerung.
Wie funktioniert die Lobry de Bruyn-van Ekenstein-Umlagerung?
Durch die Lobry de Bruyn-van Ekenstein-Umlagerung wird ein Gleichgewicht beschrieben,
wobei eine Ketose in eine Aldose umgewandelt wird. Mit Hilfe dieser Reaktion können
Carbonylgruppen innerhalb eines Kohlenhydratmoleküls „wandern“.
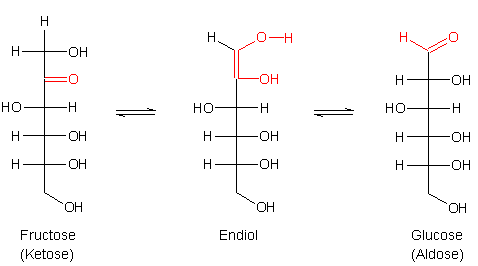
Aus der Fructose bildet sich also Glucose. Dadurch wird aus der endständigen Alkoholgruppe eine Aldehydgruppe, die dann wiederum reduzierend auf die Fehling-Lösung wirken kann. Genau genommen gilt das auch schon für die Endiol-Zwischenstufe, die der äußerst reaktiven Endiolgruppe der Ascorbinsäure entspricht. Da diese Umlagerung Zeit benötigt, läuft die Fehling-Reaktion mit Fructose deutlich langsamer ab als die mit Glucose.
Diese Umlagerungen können in beide Richtungen ablaufen. Wenn Glucose als Ausgangsstoff eingesetzt wird, wie in dem obigen Beispiel gezeigt, entsteht durch Umlagerung Fructose.
Nicht dargestellt ist hier die Möglichkeit zur Bildung eines dritten Zuckers, der Mannose. Bei ihr steht die OH-Gruppe auf der linken Seite – verglichen mit der Glucose.
Stereochemische Konsequenzen der Lobry de Bruyn-van Ekenstein-Umlagerung
Schon in der Stufe des Endiols befindet sich kein Chiralitätszentrum
mehr am C2-Atom, das heißt, die stereochemische Anordnung der Substituenten geht zunächst
verloren. Es kann allerdings zu jedem Zeitpunkt eine Rückreaktion stattfinden, was zur Folge hat, dass
bei der Neubildung des Stereozentrums am C2-Atom zwei unterschiedliche Stellungen der
Substituenten möglich sind. Bei der Rückreaktion vom Endiol zur Aldose können also zwei Produkte entstehen:
Glucose mit der OH-Gruppe nach rechts und Mannose mit der OH-Gruppe nach links.
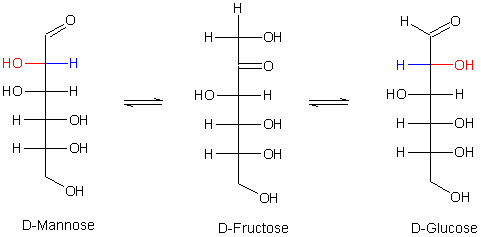
Mannose und Glucose sind epimere Verbindungen, denn sie unterschieden sich nur in ihrem Asymmetriezentrum an C-Atom 2. Zur genauen Definition dieses Begriffs lies hier.
Weitere Texte zum Thema „Kohlenhydrate“