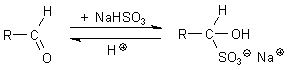
Additionsreaktionen der schwefligen Säure
Experimente:
Versuch: Addition von Hydrogensulfit an Aldehyde
Versuch: Chemie des Tintenkillers
Versuch: Herstellen von Schiffs Reagenz
Die schweflige Säure spielt für die organische Chemie eine wichtige Rolle. Vor
allem ist sie für die Einführung von Sulfonsäuregruppen R-SO3H
von Bedeutung. Voraussetzung zur Reaktion ist das Vorliegen von polaren Doppelbindungen.
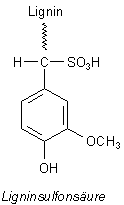
Addition von Hydrogensulfit an Aldehyde
Dahinter steckt der nucleophile Angriff des S-Atoms auf das positiv polarisierte C-Atom der
Carbonylgruppe.
Diese Addukte fallen als gut kristallisierende Natriumsalze rasch aus (-> Versuch). Sie lassen sich durch warme Mineralsäuren leicht wieder zerlegen. Man nutzt sie deshalb vor allem, um Aldehyde abzutrennen.
Die Additionsreaktion kann auch genutzt werden, um den Stoffwechsel von Mikroorganismen zu
stören. Das betrifft zunächst vor allem die Glykolyse.
Hier ist aber die hohe Toxizität von Schwefeldioxid auf den Menschen zu sehen. Denn an vielen
Reaktionen im Körper sind Aldehyde beteiligt. Sogar das für den Aminosäurestoffwechsel bedeutsame
Vitamin B6 ist - wie der Name Pyridoxal schon ausdrückt - ein Aldehyd.
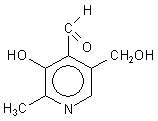
Pyridoxal (Vitamin B6 )
Addition von Hydrogensulfit an Triphenylmethanfarbstoffe (TPM-Farbstoffe)
In der Schule ist die Untersuchung der Reaktion mit vielen TPM-Farbstoffen
ganz besonders bekannt. Hydrogensulfit greift in diesen Verbindungen das zentrale, positiv polarisierte
C-Atom nucleophil an. Das tetraedrische Addukt ist sp3-hybridisiert und deshalb nicht
mehr planar. Die Verbindung wird farblos. Ein Leukofarbstoff ist entstanden.
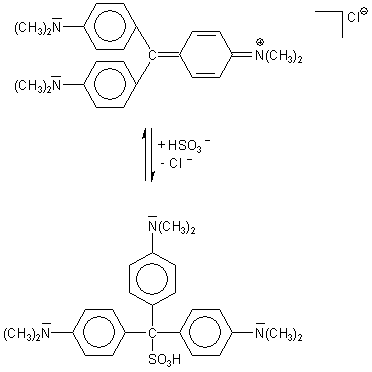
Die Reaktion spielt bei der Funktion der Tintenkiller eine zentrale Rolle.
Auch diese Additionsreaktion ist reversibel. Das gilt vor allem dann, wenn eine andere Verbindung mit dem Farbstoffmolekül um das Hydrogensulfit-Anion konkurriert. Das sind vor allem die Aldehyde.
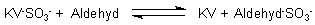
Besonders wichtig ist die Reaktion mit Fuchsin (-> Versuch). Das farblose Addukt heißt Fuchsinschweflige Säure.
Es ist unter der Bezeichnung Schiffsches Reagenz als Nachweismittel für Aldehyde bekannt. Gibt man einen Aldehyd dazu, so entreißt dieser dem Leukofarbstoff das Hydrogensulfit. Die Lösung färbt sich daraufhin wieder fuchsinrot. Eine Einschränkung: Der Reaktionsmechanismus ist nicht ganz klar. Es bilden sich nämlich mit verschiedenen Aldehyden auch verschieden Farbtöne aus, vor allem, wenn man den zurückgebildeten Farbstoff noch mit Salzsäure traktiert... (Siehe Kurze Fragen/Kurze Antworten Nr. 674.)
Addition von Hydrogensulfit an Lignin
Holzaufschlussverfahren (/dc2/papier/dc2pt_2.htm)
dienen dazu, Cellulose zu gewinnen. Dazu müssen die Inhaltsstoffe voneinander getrennt werden.
Das Problem ist, die vielen Cellulosebegleitstoffe unter möglichst weitgehendem Erhalt der
Cellulosestruktur abzutrennen. Dabei ist vor allem das Lignin, das das Holz dunkel färbt, möglichst
quantitativ herauszulösen.
Lignin und Cellulose sind untereinander chemisch vor allem durch Wasserstoffbrücken verbunden. Nun könnte
man ja Salze oder Säuren hinzufügen, um die beiden Stoffe zu trennen. Dann hat man aber immer noch das Problem,
dass das Lignin nicht wasserlöslich ist. Deshalb muss man es wasserlöslich machen. Das geschieht durch
Sulfonierung zum Beispiel mit dem Aufschlussmittel Calcium-Hydrogensulfit Ca(HSO3)2.
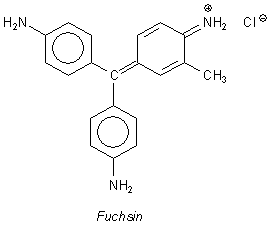
Hydrogensulfit-Ionen addieren sich an aktivierte Stellen des Ligninmoleküls. Die folgende Strukturformel
zeigt das typische "Monomere" des Biopolymers Lignin.
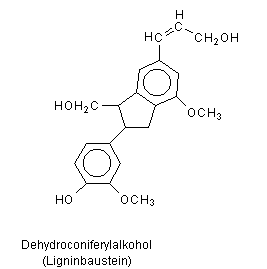
Die so erhaltene Ligninsulfonsäure ist anders als Lignin in Wasser gut löslich und kann somit durch Ausspülen von der in Wasser ebenfalls unlöslichen Cellulose abgetrennt werden.
Weitere Texte zum Thema „Schwefel“