Prof. Blumes Tipp des Monats Mai 2014 (Tipp-Nr. 203)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Morin
Viele natürliche Farbstoffe enthalten den zusammengesetzten Heterocyclus Chroman (griech. chroma, Farbe). Davon abgeleitet sind Chromen und Chromon.
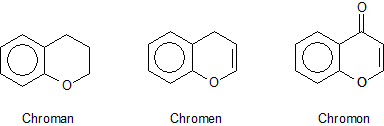
Während Chroman im Wesentlichen nur in Gerbstoffen wie den Cathechinen
vorkommt, sind Chromen und Chromon Bestandteile von polyphenolischen Blüten- und Holzfarbstoffen. Diese
Naturstoffgruppe scheint unendlich viele Substanzen aufzuweisen.
Wir haben schon ausführlich über das Cyanidin als typischen Vertreter der Chromen-Farbstoffgruppe der Anthocyane berichtet. Vertreter der Chromonfarbstoffe gibt es unter der Bezeichnung Flavone. Diese spielen in den gelben Rosen und anderen gelben Blumen die Hauptrolle; im Eichenholz ist das gelbe Quercetin enthalten.
Nun sind diese Farbstoffe nicht nur hübsch anzusehen. Sie finden durchaus technische Anwendungen, so das Cyanidin als zweistufiger Säure/Base-Indikator. Sagenhaft ist das Experimentieren mit Rotkohlsaft als Indikatorlösung, womit schon in Kindergarten und Grundschule Chemikerkarrieren starten können. Auch für Flavone gibt es Anwendungen, z. B. in der Gerberei oder Färberei.
Hier wollen wir uns mit dem Gelbholzbaum befassen
Der Baum trägt den wissenschaftlichen Namen Morus tinctoria. Letzteres weist darauf hin, dass man das Holz
des Baums zu Färbezwecken nutzt (lat. tingere, färben).
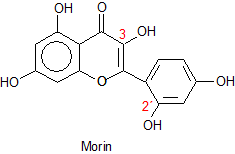
Sein Farbstoff Morin ist eine gelbbraune Substanz.

Bild 1: Morin-Pulver
(Foto: Daggi)
Die Strukturformel von Morin zeigen wir hier:
Bei den primär allgemein angelegten Untersuchungen („Screening“), wie sich ein Naturstoff chemisch verhält, bringt
man ihn auch mit dreiwertigen Metall-Ionen zusammen. Damit kann man u. a. herausfinden, ob die betreffende Substanz zum
Beizenfärben infrage kommt. Da das Aluminium-Ion selbst farblos ist, eignet es sich
ganz besonders für solche Untersuchungen. Dabei fand man die besonderen Eigenschaften des Morins heraus: Es bildet mit Al-Ionen
einen Komplex, der intensiv blaugrün fluoresziert. So liegt es nahe, dass man diesen Farbstoff nicht nur zum Färben, sondern
auch als Fluoreszenzindikator zum Nachweis von Aluminium-Ionen nutzen kann. Die Reaktion ist so empfindlich, dass man noch
0,2 μg Al nachweisen kann.
|
Versuch: Nachweis von Aluminium mit Morin
|

Bild 2: Nachweis von Aluminium mit Morin
Links: Ohne Aluminiumsalz
Rechts: Mit Aluminiumsalz
(Foto: Daggi)
Wie der Komplex aufgebaut ist
Der Komplex ist ein Chelat. Er bildet sich mit den Hydroxylgruppen in 3-
und 2´-Stellung. Dazu müssen die beiden OH-Gruppen nebeneinander liegen. Das ist durchaus möglich, weil sich der einzelne
Benzolring drehen kann.
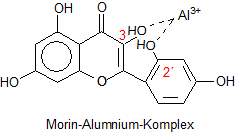
Es ist anzunehmen, dass zwei oder drei Morinmoleküle an ein Aluminium-Ion andocken. Letztlich ist der Komplex ähnlich
aufgebaut wie der in Beizen mit Alizarin.
Warum fluoresziert der Al-Morin-Komplex überhaupt?
Morin und auch der Komplex absorbieren als gelber Farbstoff blaue Strahlung. Normalerweise dient die Energie des Lichts dazu,
das Molekül zum Schwingen oder zu Rotationen anzuregen. Die Rotation betrifft nicht nur das gesamte Molekül in Lösung,
sondern besonders auch Rotationen um die Bindung zwischen dem einzelnen Bezolrest am Pyronring. Das gilt auch für Schwingungen
innerhalb des Moleküls. Das zeigt beispielhaft das folgende Bild.
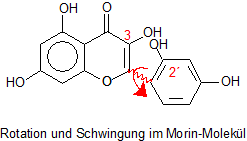
Durch Rotation und Schwingung wird die Strahlungsenergie nach und nach entwertet, das heißt die hochwertige Strahlungsenergie
wandelt sich in kinetische Energie um, was letztlich zu einer Erwärmung der Umgebung führt.
Wenn der freie Benzolring allerdings durch die Bindung an die Aluminium-Ionen fixiert ist, ist keine Rotation mehr möglich. Folge dieser „Versteifung“ ist, dass die eingestrahlte Energie nicht mehr vollständig als Wärme abgegeben werden kann. Sie muss aber das Molekül verlassen, da ständig neue Energie ins Molekül hineingepumpt wird. Energieabgabe ist deshalb nur möglich, wenn innerhalb einer Millionstel Sekunde überschüssige Energie als Strahlung abgegeben werden kann. Das heißt, dass das Molekül fluoresziert. Da ein Teil der eingestrahlten Energie bereits zur Anregung von Schwingungen und Rotationen verbraucht worden ist, muss die Fluoreszenzstrahlung von geringerer Energie sein. Sie weist tatsächlich eine längere Wellenlänge auf als die blaue Anregungsstrahlung. Deshalb ist das Fluoreszenzlicht grün.
Zur Fluoreszenz von Mineralien klicke hier.
Einbindung in den Unterricht
Versuche zum Nachweis von Aluminium können in andere unterrichtliche Themenbereiche („Kontexte“) eingebunden werden. Ein Beispiel
ist der Nachweis von Aluminium in der Asche von geleimtem Papier ( -> Versuch). Auch im
blutstillenden Rasierstein aus Alaun kommt Aluminium vor. In letzter Zeit ist
Aluminium als Bestandteil von Deostiften ins Gerede gekommen. Man kann ja seinen Deostift darauf hin
untersuchen. In diesem Zusammenhang ist interessant, dass Essigsaure Tonerde immer noch als weitverbreitetes und intensiv
genutztes Hausmittel zur Behandlung von Prellungen, Hautschäden, Insektenstichen, Entzündungen (und so weiter) dient.
Essigsaure Tonerde ist nichts anderes als eine altertümliche Bezeichnung für Aluminiumacetat. Negative Auswirkungen wie angeblich
Brustkrebs bei Gebrauch von Deostiften sind nicht überliefert.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 29. April 2014, Dagmar Wiechoczek