Prof. Blumes Tipp des Monats Juni 2004 (Tipp-Nr. 84)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Lecithin - ein Fett der Gegensätze

Bild 1: Lecithin (Foto: Daggi)
Lecithin ist in allen lebenden Organismen zu finden. So ist es im tierischen Körper
weit verbreitet. Besonders viel findet man in den Markscheiden des Nervengewebes, in den Zellmembranen
und im Eidotter. Daher stammt nicht nur sein Name (griech. lekithos; Eidotter). Aus Eigelb
kann man es auch leicht gewinnen.
Wer sich dieser Prozedur nicht unterwerfen will, kann Lecithin auch kaufen. Das gibt es zum Beispiel bei der Firma Roth in Karlsruhe. (Lecithin aus Eiern; 25 g kosten 25,20 Euro.)
|
Versuch 1: Herstellung von Lecithin aus Eigelb
Ergebnis:
Wir können das so hergestellte Lecithin vom Eigelb unterscheiden, indem wir von beiden je eine Probe einige Tage offen stehen lassen. Während das Eigelb zunehmend eine trockne Kruste bildet, verändert sich Lecithin nicht. Das so hergestellte Lecithin muss bald verbraucht werden. Im Kühlschrank aufbewahren! |


Bild 2: Herstellung von Lecithin aus Eigelb; rechts die ersten Ergebnisse
(Fotos: Daggi)
Weiter ist Lecithin neben den Gallensäuren Bestandteil der Gallenflüssigkeit, die
bei der Fettverdauung eine wichtige emulgierende Rolle spielt. In der Leber
gebildetes Lecithin ist die wichtigste Transportform von Fettsäuren im
Blutplasma.
Außerdem ist Lecithin auch in allen Pflanzen zu finden, hier vor allem in den Früchten. Besonders viel davon enthält die Sojabohne.
Grundlage für die biologischen Wirkungen von Lecithin sind seine besonderen Eigenschaften, die letztlich auf seiner Struktur beruhen. Einen Hinweis gibt die Beobachtung, dass Lecithin besonders dort anzutreffen ist, wo biologische Membranen durchlässig gemacht werden oder Emulsionen zu stabilisieren sind. Dies muss am besonderen Aufbau des Moleküls liegen.
Deshalb zunächst einen Einblick in seine Eigenschaften
Lecithin ist ein Stoff der Gegensätze. Einige seiner Eigenschaften entsprechen denen von
unpolaren Fetten, andere eher denen von polaren ionischen Verbindungen. Man
bezeichnete Lecithin früher daher oft nicht als Lipid, sondern als Lipoid, d. h.
als fettartigen Stoff. Deshalb vergleichen wir es in unseren Versuchen
mit "normalen" Fetten wie Sonnenblumenöl.
Obwohl das Lecithin zu den Fetten zu zählen ist, ist die Fettfleckprobe negativ.
|
Versuch 2: Fettfleckprobe
|
Lecithin hat noch weitere Eigenschaften, in denen es sich von den klassischen Fetten stark unterscheidet. Das wollen wir zeigen.
Zunächst einmal ist Lecithin nicht in allen typischen Fettlösemitteln löslich.
|
Versuch 3: Löslichkeit von Lecithin
Ergebnis:
|

Bild 3: Von links nach rechts: Lecithin in Aceton, Ethanol, n-Heptan und Wasser
(Foto: Daggi)
Mit dem Aceton lässt sich Lecithin sogar aus seinen Lösungen ausfällen.
|
Versuch 4: Mit Aceton kann man gelöstes Lecithin ausfällen
Ergebnis:
|


Bild 4: Lösungen von Sonnenblumenöl und von Lecithin in Heptan (links) und mit Acetonzusatz (rechts)
(Fotos: Daggi)
Aus diesem Grunde kann man Lecithin aus Eigelb isolieren, indem man mit Aceton die anderen
löslichen Fettkomponenten ausspült (-> Versuch 1).
Zur weiteren Untersuchung von Lecithin erhitzen wir eine Probe bis zur völligen Zersetzung. Das ist zwar nicht angenehm, bringt aber Erkenntnisse bezüglich der Zusammensetzung der Substanz.
|
Versuch 5: Erhitzen von Lecithin, Geruchsprüfung und Untersuchung des Rückstands
Ergebnisse:
Bild 5: Erhitzen von Lecithin (Foto: Daggi)
Der feste Rückstand wird zerkleinert und mit 5 ml verdünnter Salpetersäure (c = 2
mol/l; C) heiß extrahiert. Verdünne mit 5 ml Wasser, filtriere in ein
Reagenzglas, gib 2 ml einer salpetersauren Lösung von Ammoniummolybdat (C)
hinzu. Dann musst du vorsichtig bis zum Auftreten eines gelben Niederschlags
oder einer Gelbfärbung erwärmen.
|

Bild 6: Links: Phosphatnachweis mit der filtrierten Lösung des Rückstands von Lecithin
Rechts: Zum Vergleich verdünnte Phosphat-Lösung
(Foto: Daggi)
Wenn der Dampf fischig riecht und ein Indikatorpapier eine Base anzeigt, erinnert das an organische
Stickstoffverbindungen, an Amine. Die müssen in dem Molekül gebunden sein.
Außerdem riecht die erhitzte Probe stechend. Es handelt sich um das bekannte Zersetzungsprodukt
von Glycerin Acrolein. Das ist ein ungesättigter Aldehyd. Der bildet
sich auch beim Erhitzen von Fetten.
Den nicht weiter zersetzlichen Rückstand identifizieren wir als Phosphat.
Das wird gestützt durch das Verhalten von Lecithin gegenüber Ionen von Schwermetallen
wie Kupfer, Cadmium oder Quecksilber. Mit ihnen bildet Lecithin schwerlösliche
Salze. Es muss also auch die Eigenschaften eines Anions haben.
|
Versuch 6: Reaktion von Lecithin mit Schwermetallsalzen
Ergebnis:
|

Bild 7: Lösungen von Lecithin und Sonnenblumenöl mit und ohne Zusatz von alkoholischer Kupfer(II)-chlorid-Lösung
(Foto: Daggi)
Es muss sich also eine negative Ladung im Lecithinmolekül befinden. Es handelt sich um einen
Phosphorsäurerest. (Übrigens bilden auch Calcium-Ionen mit dem Phosphatrest des
Lecithins schwerlösliche Salze. Sie sind ein nicht unwesentlicher Bestandteil von
Gallensteinen (Frage 800). Die Ca-Salze lassen sich aber im Reagenzglasversuch
nicht herstellen.)
Um noch mehr über den Aufbau des Moleküls zu erfahren, unterwerfen wir das Lecithin einem schonenden Abbau, der alkalischen Hydrolyse.
|
Versuch 7: Schonende Hydrolyse von Lecithin
1. Nachweis der Fettsäuren
2. Nachweis von Phosphat
3. Nachweis von Glycerin
Ergebnisse:
|


Bild 8: Links: Nachweis auf Phosphat, rechts: Nachweis auf Glycerin
(Fotos: Daggi)
Nun schauen wir uns das Molekül genauer an
Das Molekül des Lecithins ist zunächst ähnlich wie ein Fett aufgebaut. Es ist ein Ester des Glycerins, bei dem aber nur die erste und zweite OH-Gruppe mit einer Fettsäure verestert ist. Eine von den beiden Fettsäuren ist fast immer ungesättigt. Es handelt sich meistens um Linolensäure.
|
Versuch 8: Untersuchung von Lecithin auf Doppelbindungen
Ergebnis:
|
Neben diesem lipophilen Teil enthält das Lecithin-Molekül einen hydrophilen, elektrisch zugleich negativ wie positiv geladenen Abschnitt. Die Ladungen rühren von einem Phosphatrest und von einem stickstoffhaltigen Molekülteil, dem Cholin her. (Nun verstehen wir auch die chemische Bezeichnung von Lecithin, Phosphatidylcholin.)
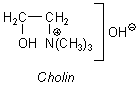
Der Cholinrest ist letztlich Ursache für den fischartigen Geruch bei der Zersetzung von Lecithin in der Hitze sowie für die alkalische Reaktion des Dampfes, die an Ammoniak erinnert. Der Cholin-Stickstoff ist vierbindig und deshalb positiv geladen. (Vergleiche das mit dem Ammonium-Ion!) Vierbindigen Stickstoff kennen wir auch von den kationischen Tensiden, den so genannten Neutralseifen. Die haben den Vorteil, dass sie (anders als die alkalisch reagierende klassische Seife) ihren Tensidcharakter entfalten, ohne dass der pH-Wert ins Alkalische abwandert. Die beiden entgegengesetzten Ladungen sind im Molekül räumlich fixiert und können sich intramolekular nicht gegenseitig eliminieren. Damit stellt das Molekül einen stabilen elektrischen Dipol dar.
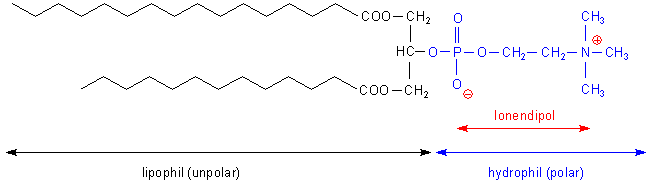
Lecithin ist ein Emulgator
Seine polaren Eigenschaften haben zur Folge, dass Lecithin als hervorragender Lösungsvermittler zwischen Fetten
und Wasser wirken kann. Es ist ein klassischer Emulgator.
|
Versuch 9: Lecithin ist ein Emulgator
|

Bild 9: Reagenzglas 1: Versuch 9 a)
Reagenzglas 2: Versuch 9 b)
Reagenzgläser 3 und 4: Versuch 9 c)
(Foto: Daggi)
Diese Eigenschaft beruht auf der Struktur des Lecithin-Moleküls. Das lipophile
Ende taucht ins Fetttröpfchen, das hydrophile Ende in das Wasser. Lecithin ist
also wie die Gallensäuren ein grenzflächenaktiver Stoff
biologischer Herkunft.
Lecithin selbst löst sich sofort in Wasser, da es sich selbst emulgiert. Es ist auch der Emulgator vom Eigelb der Hühnereier. Die Rolle eines Emulgators spielt das Lecithin auch bei der Herstellung von Mayonnaise oder von Margarine.
Biologische Rolle von Lecithin
In Lebewesen ist Lecithin zur Durchlässigkeit von Grenzflächen wie etwa den
Zellmembranen unverzichtbar. Am Aufbau dieser Membranen sind Fette beteiligt,
die nach innen und außen an wässrige Lösungen angrenzen. Die Membran besteht
aus einer Lipid-Doppelschicht. Damit ein Kontakt zwischen Innen- und Außenraum
der Zellen möglich wird, sind Transportproteine notwendig. Deren äußere Hülle
besteht aus ausgesprochen hydrophilen Aminosäureresten. Sie werden in den
ansonsten lipophilen Membranen durch Lecithin (und andere Phosphorlipide) fixiert.
Lecithin hilft also bei der Bildung hydrophiler Fenster in der ansonsten
undurchlässigen Biomembran. So können Ionen, wasserlösliche Substanzen und
Wassermoleküle hindurchgeschleust werden.
Besonders viel Fett ist in Nervenzellen bzw. deren Leitungsbahnen vorhanden. Deshalb ist das Vorkommen von Lecithin typisch für Nervenzellen und für deren Funktion Voraussetzung. Ob aber Lecithinpräparate deshalb das Denken oder gar die Intelligenz fördern (wie die Werbung vorgaukelt - so gibt es ein Präparat "Buer-Lecithin", auf das alte Leute geradezu süchtig sind), ist umstritten. Schließlich wird Lecithin ja im Darm hydrolysiert und gelangt gar nicht direkt in die Blutbahn bzw. ins Gehirn.
Nun verstehen wir, weshalb Phosphat für uns so wichtig ist. Wenn man zum Lecithin auch noch den Phosphatgehalt von Nucleotiden und Nucleinsäuren und den Energiestoffwechsel in Betracht zieht (Stichwort ATP), wird die Rolle von Phosphat in Lebensmitteln deutlich. Aber vor einem "Zuviel" wird bekanntlich auch gewarnt.
Rüdiger Blume
Literatur:
R. Blume und Koll.: Lehrerband zum Themenheft Chemie für Gymnasien (Fette, Seifen und Waschmittel),
Cornelsen-Verlag, Berlin 1994.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 02. Dezember 2014, Dagmar Wiechoczek

