Prof. Blumes Tipp des Monats Juni 2006 (Tipp-Nr. 108)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Zur Fußball-Weltmeisterschaft 2006:
Das Fußball-Molekül
Alles redet von der Fußballmeisterschaft. Auch Chemiker spielen gerne mit dem Fußball - nicht nur auf dem Platz. Es ist Zeit, mal wieder an das Fußball-Molekül zu erinnern.
Dieses Molekül war in den Neunziger Jahren des 20. Jahrhunderts der große Aufreger: Der englische Chemiker Harold Walter Kroto hatte zusammen mit dem Amerikaner Richard Smalley 1985 einen Verband aus 60 Kohlenstoffatomen entdeckt, der (wie Kroto herausfand) die Form eines Fußballs hatte. Es stellte sich heraus, dass es sich hierbei nicht nur um eine neue Kohlenstoffmodifikation mit vielen strukturellen Vertretern handelte, sondern sogar um eine echte chemische Verbindung, deren Eigenschaften denen eines Alkens glichen. Genau genommen sind Fullerene ungesättigte Kohlenwasserstoffe ohne Wasserstoffatome. Das fußballförmige Molekül hat die Formel C60. Von jedem C-Atom gehen zwei Einfach- und eine Doppelbindung aus.
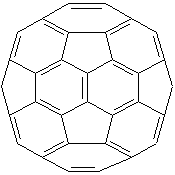
Struktur des Buckminsterfullerens
Benannt haben Kroto und Smalley das C60-Molekül nach dem Architekten R. Buckminster
Fuller, der in dieser Zeit auf der Weltausstellung in Montreal mit seinen Kuppelbauten Furore
machte: Buckminsterfulleren
 |
| Bild 1: Der amerikanische Pavillon auf der Weltausstellung in Montreal
(Foto: Thomas Blume) |
Überall in der Welt machten Wissenschaftler die 1996 mit einem Nobelpreis geadelten Arbeiten
von Kroto und Smalley (und dem Deutschen W. Krätschmer, der sich um die Optimierung der
Synthese gekümmert hat, um überhaupt wägbare Mengen dieser Substanz zu erhalten) nach. Manch ein
Ordinarius kratzte gar den Ruß aus seinem Kamin und ließ ihn durch seine Doktoranden analysieren...
(Das ist tatsächlich passiert!)
Mittlerweile ist es ruhiger geworden um die Fullerene. Denn die Möglichkeiten der technischen Verwendung dieser Moleküle und ihrer Derivate waren doch begrenzt und erfüllten vor allem in der Medizin sowie in der Nanotechnologie die Erwartungen nicht. Nur die mit ihnen verwandten langen Kohlenstoffröhren sind unter dem Namen "Nanoröhren" oder Microtubes im Gespräch geblieben. "Kohlenstoff-Nanoröhrchen sind 50-mal stärker als Stahldraht und leiten 1000-mal mehr Strom als Kupferdraht" (Zitat aus National Geographic Deutschland, Juni 2006) - leider sind sie für praktische Anwendungen noch nicht lang genug...
Trotzdem ist es an der Zeit, sich wieder einmal dieser Verbindungen zu erinnern. Dabei sollten wir die Schönheit dieser natürlichen Strukturen in den Mittelpunkt stellen. Gut, dass die Form des Fußballs urheberrechtlich nicht geschützt ist, sonst hätten wir Chemiker echte Schwierigkeiten.
Greifen Sie aus Anlass der Fußballweltmeisterschaft doch die Fullerene im Chemieunterricht auf! Das sind die berühmten Fußball-Moleküle. Der kleine Robin allerdings zeigt ein besonderes Ball-Exemplar: Das besteht nur aus 12 Fünfecken und ist sozusagen die Mutter aller Bälle.

Bild 2 (Foto: Blume)
Diesen einfachsten aller Balltypen kennen wir aus dem Bereich der unbelebten Natur. Es ist das
Pentagondodekaeder, eine kubische Kristallform. Es ist typisch für den
Pyrit.

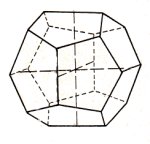
Bild 2a: Pentagondodekaeder von Pyrit
Wo das Pentagondodekaeder sonst noch eine Rolle spielt, zeigen wir im Tipp des Monats Nr. 114.
Erklären Sie das Fullerenprinzip. Das lässt verstehen, wie aus 32 Flächen eine kugelige Struktur zusammengesetzt werden kann. Wir lernen dabei die Fullerene als aufgeweitete Pentagondodekaeder oder als abgestumpfte Ikosaeder kennen. Bauen Sie mit den Schülern Modelle. Diskutieren Sie mit ihnen, aus wie vielen Fünfecken und Sechsecken eine solche Kugel zusammengesetzt ist. Lassen Sie auch berechnen, wie viele Kanten (Bindungen) die 60 "Ecken" verbinden (-> Lösung). Dabei beachten Sie: Von jedem C-Atom gehen drei Bindungen ab. Denn eine Doppelbindung ist letztlich auch nur eine "Kante".
Lassen Sie die Kinder zum Beispiel erklären, warum manche in Zeichnungen dargestellte Bälle nicht rollen können. Das betrifft die Darstellungen von Fußbällen, die nur aus Sechsecken bestehen.
Auch für die Regel, dass ausschließlich aus Sechsecken bestehende Flächen flach sein müssen, gibt es im Fußballspiel einen Beleg: Das flache WM-Tornetz ist aus lauter Sechsecken zusammengesetzt. Es beult nur aus, wenn ein Ball einschlägt und Deformationsenergie überträgt!
Vielleicht können Sie auch die eine oder andere chemische Reaktion mit Fullerenen vorführen. Ablaufende Reaktionen sind sehr leicht zu erkennen, da Fullerene und ihre Derivate prächtig gefärbte Lösungen zeigen.

Bild 3: Lösung von C60 in Toluol (c = 3 mg / 10 ml )
(Foto: Daggi)
Last but not least zur WM
Wir wünschen der besten Mannschaft, dass sie die Weltmeisterschaft gewinnt. Auch wenn die Leute nicht
mehr mit einem der schönen Bälle (Bucky-Balls) spielen dürfen, die die
Fulleren-Struktur so herrlich deutlich zeigen.
Die Graphik ganz oben ist eigentlich auch nicht so ganz richtig, denn beim Buckyball sind die Doppelbindungen kürzer als die Einfachbindungen. Damit sind gibt es keine gleichseitigen Sechsecke.
Richtiger wäre es, wenn die von den Ecken der Fünfecke ausgehenden Linien kürzer sind als die Kanten der Fünfecke. Schauen Sie genau hin: Die Kanten der Fünfecke sind gleichzeitig drei Kanten der Sechsecke!
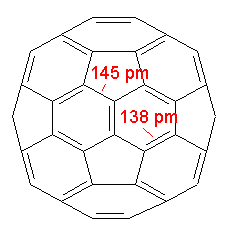
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 10. Februar 2012, Dagmar Wiechoczek