Prof. Blumes Tipp des Monats Juni 2014 (Tipp-Nr. 204)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Rohe Milch - wie erkannt?

Kühe auf der Schwäbischen Alb
(Foto: Blume)
Es wird Sommer, Zeit für Ferien auf dem Bauernhof. Da gibt es rohe Milch. Ist die wirklich nicht bearbeitet? Zum Beispiel
zum Haltbarmachen erhitzt?
Geschmacklich ist das kaum festzustellen. Ob Milch wirklich frisch ist, kann man testen. Milch enthält nämlich von Natur aus Enzyme. Mindestens eines von denen lässt sich auch mit Chemikalien aus der Schulsammlung nachweisen.
Hier ist zunächst das Experiment:
|
Versuch: Probe auf ungekochte Milch (Schardinger-Probe)
Ergebnis: Nach 1-2 Minuten entfärben sich die Proben in RG1 und RG2. Die Mischung in RG3 bleibt blau gefärbt. Die offene Probe in RG1 behält eine blaue Oberfläche. Man schüttelt die Probe gut durch. Sie wird dabei wegen des Luftzutritts wieder komplett blau. Hinweise:
|
Auch wenn das Ganze nicht so schwer aussieht: Dahinter steckt eine Menge Organische Chemie bzw. Biochemie!
Die Probe ist nach Franz Schardinger (1853-1920) benannt. Der war seinerzeit ein bekannter österreichischer Biochemiker, der sich vor allem mit dem Kohlenhydrat-Stoffwechsel der Zelle befasst hat. Den nach ihm benannten Nachweis entdeckte er zufällig 1902.
Bei dem so nachgewiesenen Enzym handelt es sich um das so genannte Schardinger-Enzym. Es katalysiert folgende, nur unter Sauerstoffausschluss ablaufende Reaktion:

Methylenblau ist ein Redoxfarbstoff. Viele kennen es zum Beispiel aus dem
Versuch zum Blauen Wunder oder auch als Modellsubstanz für Vorgänge bei der
Fotosynthese. Seine reduzierte Form ist farblos; sie heißt deshalb Leuko-Methylenblau (griech.
leukos, weiß).
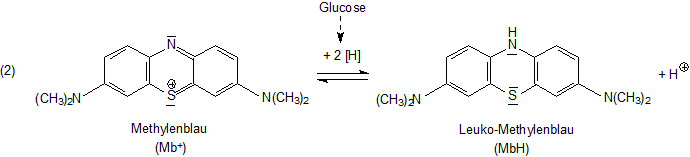
Durch Erhitzen der Milch zu Konservierungszwecken werden nicht nur schädliche Keime, sondern auch Milch-Enzyme
zerstört („denaturiert“). Das kann man mit Hilfe der Schardinger-Probe zeigen. Deshalb dient diese Probe auch als Nachweis von
durchgeführter Milcherhitzung.
Was eigentlich ist das Schardinger-Enzym?
Es handelt sich um eine Aldehyd-Oxidase oder um mehrere Enzyme aus dieser Enzymgruppe. Für die steht beispielhaft die
Xanthin-Oxidase. Als funktionelle Gruppe enthält diese Oxidase zunächst einmal Flavin. Man spricht von einer
prosthetischen Gruppe (griech. prostanai, vorstehen). Das ist eine an ein Protein fest (meist komplex oder kovalent)
gebundene Nicht-Eiweiß-Komponente, die erst die spezifische (meist katalytische) Wirkung des Proteins ermöglicht. Hinzu kommen beim
Schardinger-Enzym noch gebundene Metall-Ionen von Molybdän (Mo(VI)) und Eisen (Fe(III)).
Proteine mit Fremdgruppen bezeichnet man als Proteide. Es handelt sich somit bei der Xanthin-Oxidase um ein
Metallo-flavo-proteid.
Flavin heißt genau genommen Riboflavin, ist also identisch mit Vitamin B2. Im Protein liegt es als Flavin-adenin-dinucleotid (FAD) vor.
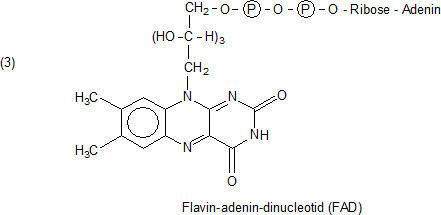
Der Mechanismus der durch Flavin katalysierten Redox-Reaktionen beruht auf folgendem Vorgang, der letztlich eine Elektronenübertragung ist:
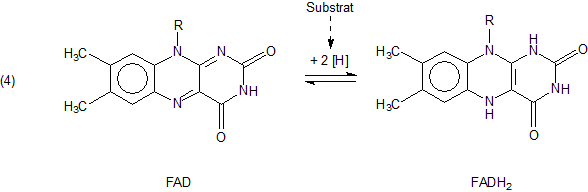
Katalysiert wird die Reaktion durch die Oxidase. Sie überträgt den Wasserstoff (Symbol [H]) vom Substrat unter Einschaltung von FAD/FADH2
direkt auf Sauerstoff, wobei Wasserstoffperoxid (H2O2) entsteht. Es handelt sich
insgesamt um einen komplexen Radikalmechanismus, bei dem die H- und O-Atome schrittweise übertragen bzw. zusammengeführt werden.
Dabei spielen die Molybdän und Eisen im Enzym eine wichtige Rolle, die erklärt werden muss.
Zunächst sei daran erinnert, dass bei gewöhnlichen Redox-Reaktionen der organischen/biologischen Chemie normalerweise zwei Elektronen simultan übertragen werden. Dagegen hat die Bildung von Radikalen sukzessive Einelektronen-Übertragungen zur Voraussetzung. Daran sind Metallatome vor allem von Nebengruppen beteiligt, da sie leicht zu Wertigkeitswechseln neigen, wie auch in diesem Fall:
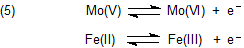
Wie überhaupt gelangt der Sauerstoff in das Substratmolekül?
Der stammt sicherlich nicht aus dem Sauerstoff der Luft. Bei der Oxidase-Reaktion (1) ist auch ein Wassermolekül beteiligt. Dessen
Sauerstoffatom ist dasjenige, welches ins Substrat eingebaut wird. Um das zu verstehen, muss man wissen, dass Aldehyde in wässriger Lösung
zum Teil als Hydrate vorliegen.
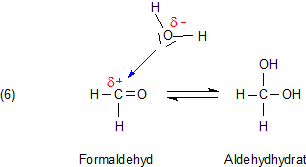
Diese Hydrate sind die eigentlichen Substrate für die Aldehyd-Oxidasen.
Die Gesamtreaktion der Aldehyd-Oxidasen
Das folgende Reaktionsschema zeigt die Gesamtreaktion in physiologischer Umgebung wie z. B. einer Leberzelle. Sie läuft so aber auch in
der rohen Milch ab.
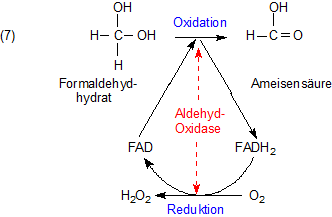
Nicht nur in der Zelle, sondern auch in roher Milch wird das H2O2 durch Peroxidasen wie z. B. die
Katalase entgiftet.
Bei der Schardinger-Probe dient wegen der Abwesenheit von Sauerstoff Methylenblau als Akzeptor für Wasserstoffatome bzw. Elektronen.
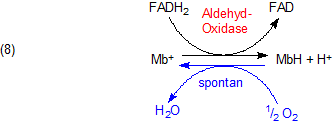
Das Leuko-Methylenblau kann durch Sauerstoff wieder zu Methylenblau oxidiert werden. Damit schließt sich (abgesehen von der
H2O2-Bildung) der übliche Reaktionsweg der Aldehyd-Oxidase-Reaktion.
Zur verwirrenden Benennung des Schardinger-Enzyms
Für Lernende ist die Benennung des Schardinger-Enzyms ziemlich verwirrend.
Manche Quellen sprechen nur von der Xanthin-Oxidase. Letztere reagiert aber nicht nur mit Xanthin, sondern auch mit Aldehyden wie Formaldehyd und Acetaldehyd. Manche Autoren benennen deshalb das Schardinger-Enzym auch schlicht mit Aldehyd-Oxidase.
Das ist jedoch nicht ganz richtig, denn der Begriff „Aldehyd-Oxidasen“ ist zu allgemein. Er umfasst vielmehr eine Gruppe von Flavo-Enzymen, die die Oxidation von Aldehyden zu Carbonsäuren unter gleichzeitiger Bildung von Wasserstoffperoxid katalysieren. Die Formaldehyd-Oxidase überführt zum Beispiel bei der Entgiftung von Methanol Formaldehyd in Ameisensäure. Erinnert sei auch an die Glucose-Oxidase (GOD); diese katalysiert die Oxidation der Glucose (bekanntlich ein Aldehyd) zu Gluconsäure. Dieses Enzym kennen wir von den Glucose-Nachweissticks. Wie die Xanthin-Oxidase reagieren alle Aldehyd-Oxidasen bei Ausschluss von Sauerstoff mit Methylenblau.
Weil das Schardinger-Enzym umgekehrt betrachtet auch Reduktionen katalysiert (vergl. Gl. (7)), nämlich die von Sauerstoff zu H2O2 bzw. von Methylenblau zu Leuko-Methylenblau (Gl. 8), spricht man auch von einer Reduktase und nennt die Schardinger-Probe auch Reduktase-Probe.
Wegen seiner Fähigkeit, aus einem Substrat Wasserstoff abzuspalten, ordnen manche Autoren die Xanthin-Oxidase der Gruppe der Dehydrogenasen zu. Das ist nicht ganz glücklich, denn Dehydrogenasen übertragen definitionsgemäß den Substrat-Wasserstoff nur auf NAD+ bzw. NADP+, ohne dass H2O2 entsteht.
Hinweis
Heute weist man auch feinste Veränderungen der Milch anhand anderer, weitaus differenzierender Enzymreaktionen nach. Hierüber berichten wir
hier. Ganz besonders gern genutzt wird die so genannte Alkalische Phosphatase, die besonders
thermolabil ist. Es handelt sich um ein Enzym, das hydrolytisch Phosphorsäureester spaltet. Alkalisch
bedeutet, dass es sein pH-Maximum bei pH 9 hat.
Literatur:
[1] Experiment nach: Physiologisch-Chemisches Praktikum. Manuskript des Physiologisch-Chemischen Instituts der Universität
Tübingen 1964.
[2] E. Buddecke: Grundriss der Biochemie. Walter de Gruyter-Lehrbuch. Berlin 1971.
[3] H. Beyer: Lehrbuch der Organischen Chemie, S. Hirzel Verlag, Leipzig (neueste Auflage).
[4] J. Falbe und M. Regitz (Hrsg.): Römpp Chemie-Lexikon, Georg Thieme Verlag, Stuttgart 1990.
[5] H.-D. Belitz, W. Grosch, P. Schieberle: Lehrbuch der Lebensmittelchemie; Springer-Verlag, 6. Auflage, Berlin Heidelberg New York 2008.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 29. Mai 2014, Dagmar Wiechoczek