Prof. Blumes Tipp des Monats März 2013 (Tipp-Nr. 189)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Gefrorene Methangasblasen - nicht nur in kanadischen Seen
In seiner Ausgabe 7/2013 berichtet der SPIEGEL über gefrorene Methangasblasen („Gefrorene Rülpser“), die sich in einem kanadischen Binnensee gebildet haben. Dazu sieht man ein schönes Foto. Ist das aber etwas Besonderes?
So etwas gibt es auch bei uns - manchmal sogar direkt vor der Haustür. Das folgende Bild stammt z. B. aus Bielefeld. Es zeigt den zugefrorenen Obersee, auf dem eifrig Schlittschuh gelaufen wird. Man erkennt neben den Schlittschuh-Kratzern deutlich die eingefrorenen, linsenförmigen Gasblasen.
Klick mich an!
Bild 1: Gasblasen im Eis des Bielefelder Obersees.
Das Foto wurde im Februar 2002 gemacht
(Foto: Blume)
Wie entsteht das Methan?
Der flache See enthält viel Schlamm. Dieser zersetzt sich unter der Tätigkeit von Bakterien, welche Biomasse
zersetzen, um Energie und Substanzen für ihren Stoffwechsel und für ihre Vermehrung zu gewinnen. Dazu müssen
sie organische Verbindungen oxidieren. Das geschieht nicht durch einfachen Elektronentransfer. Vielmehr spalten
sie mit Hilfe von Enzymen (Dehydrogenasen) und Coenzymen wie NAD Wasserstoff ab.
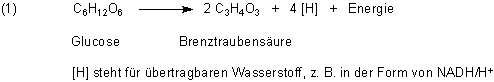
Aerobe Organismen übertragen die Wasserstoffatome bzw. dessen Elektronen auf Sauerstoff.
Anaerob lebende Organismen müssen deshalb andere Stoffe reduzieren. Man spricht dann
von Gärung.
Als Oxidationsmittel für den Wasserstoff [H] kommen bei der Gärung nicht nur organische Verbindungen wie Acetaldehyd (zur Bildung von Ethanol bei der alkoholischen Gärung) oder Brenztraubensäure (zur Bildung von Milchsäure bei der Milchsäure-Gärung) infrage, sondern auch anorganische Verbindungen wie Sulfat, Phosphat oder CO2 bzw. Hydrogencarbonat. Außerdem können auch Eisen(III)-Ionen reduziert werden.
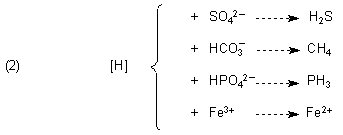
Anhand der Methanogenese soll die chemische Reaktionsgleichung ganz ausgeschrieben werden. Dazu kann man drei Schreibweisen wählen.
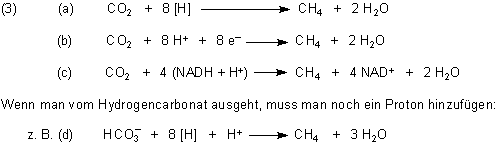
Bei der Sulfat-Reduktion spricht man auch von Sulfatatmung.
Wie man sieht, bilden sich vor allem Gase. Das Gemisch nennt man auch Sumpfgas. Es enthält neben Methan noch CO2, Wasserstoff, Phosphorwasserstoff (Phosphane) sowie Schwefelwasserstoff. Die Phosphane sind dafür verantwortlich, dass sich Sumpfgas beim Austritt aus dem Wasser und bei Kontakt mit dem Luftsauerstoff manchmal von selbst entzündet.
Bemerkenswert ist auch die parallele Bildung von Eisen(II)-Ionen und von Schwefelwasserstoff. Beide können unter bestimmten Bedingungen zu den Vorstufen von Eisen(II)-disulfid FeS2 reagieren. Dieses bildet die bekannten Mineralien Markasit und Pyrit.
Wie sich die Eisblasen bilden
Sumpfgas steigt aus bestimmten, erstaunlich konstant positionierten Bodenporen perlschnurartig auf. Die
Gasblasen durchdringen die Wasseroberfläche. Man kann sagen, dass der See wie Champagner
moussiert.
Wenn der See zufriert, kann das ständig aus der Bodenpore („Moussierpunkt“) perlende Gas nicht entweichen. Es sammelt sich unter dem Eis. So entsteht eine Gasblase. Diese wird immer größer und breitet sich dabei zu einer flachen Linse aus. Gleichzeitig wächst aber auch die Eisdecke des Sees. Wenn die Eisbildung schneller erfolgt als die Blasenvergrößerung, wird die flache Gasblase rundherum vom Eis eingeschlossen.
Da das Gas weiterhin aus der gleichen Bodenstelle ausperlt, beginnt unter der ersten „Eisblase“ die Bildung einer neuen Blase - und so geht es weiter, bis eine Reihe von Eisblasen übereinander steht.
Zur Untersuchung von Sumpfgas
Man kann das Sumpfgas auffangen, indem man über den Moussierpunkt einen mit Wasser gefüllten Glaszylinder stülpt.
Mit diesem Gas kann man einige Experimente machen.
Zunächst sollte man den Geruch prüfen. Im Allgemeinen wird man auf diese Weise die Anwesenheit von Schwefelwasserstoff feststellen.
Dann kann man die Brennbarkeit der Gasmischung untersuchen.
|
Versuch 1: Brennbarkeit von Sumpfgas
Die Brennbarkeit ist manchmal nicht besonders überzeugend. Das beobachtet man vor allem dann, wenn sich viel CO2 in der Gasmischung befindet. In diesem Fall gibt man (um das CO2 zu binden) in den mit Gas gefüllten Zylinder einige ml Natronlauge (c = 1 mol/l) (C) und schüttelt das verschlossene Gefäß ein-zwei Minuten lang. Dann verfährt man - ohne die Natronlauge auszugießen - wie oben gesagt. |
Wenn man speziell Methan nachweisen will, muss man mit einem Gaschromatographen arbeiten.
Hat das alles etwas mit Methaneis zu tun?
Nein. Methaneis bildet sich, wenn Methan und Wasser unter hohem Druck zusammen
kommen. Dann bilden sich Käfige aus Wassermolekülen, in die das Methan eingeschlossen wird. Aber man erkennt keine Blasen.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 27. Februar 2013, Dagmar Wiechoczek
