Wie Pflanzen den Benzolring basteln
Viele biochemisch relevante Verbindungen sind Aromaten auf der Basis von Benzol, also Verbindungen mit Phenylresten. Erinnert sei an die Aminosäuren Phenylalanin, Tyrosin und Tryptophan. Deren pflanzliche Synthese ist für uns Menschen besonders wichtig, denn es handelt sich um essentielle Aminosäuren, also um solche, die wir selbst nicht synthetisieren können. Wir sind deshalb auf deren Aufnahme durch pflanzliche Kost angewiesen.
Aber auch andere biochemisch relevante Stoffe gehören zu den Bio-Aromaten wie der Benzaldehyd im Prunasin, dem Gift des Kirschlorbeers, die Salicylsäure aus der Weide (Grundsubstanz von Aspirin®) und nicht zu vergessen das Lignin im Holz.
Es gibt daneben auch Heteroaromaten, also Aromaten, die neben Kohlenstoffatomen auch Fremdatome wie Stickstoff, Schwefel und Sauerstoff enthalten. Über die wollen wir hier nicht sprechen. Denn viele von denen werden auch vom tierischen Organismus synthetisiert (Beispiel: Die Stickstoff-Basen der Nucleinsäuren oder die Aminosäure Histidin).
Wie synthetisieren Pflanzen aromatische Kohlenwasserstoffe?
Um es gleich zu sagen: Aromaten aus Kohlenstoffatomen herzustellen gelingt nur Bakterien, Pilzen und vor allem den Pflanzen.
Wie immer gibt es auch hier eine Ausnahme: Das sind die Östrogene, die weiblichen Sexualhormone, die auch im Säugetier synthetisiert
werden.
Im Folgenden beschreiben wir die biochemische Aromatensynthese nur in groben Zügen.
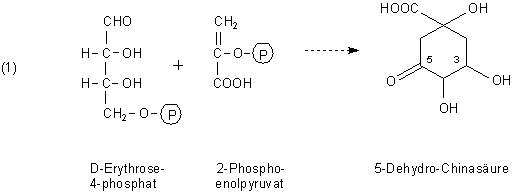
Im Zentrum der Synthesewege stehen drei Säuren, deren Namen wohl jeden Biologie- bzw. Biochemiestudierenden in den Schlaf verfolgen: Chinasäure, Shikimisäure und Chorisminsäure.
Die Synthese beginnt mit Substanzen aus dem Pentosephosphat-Zyklus (-> D-Erythrose-4-phosphat) bzw. aus der Glykolyse (-> 2-Phospho-enolpyruvat). Diese dimerisieren in mehreren Reaktionsschritten zu 5-Dehydro-Chinasäure, immerhin schon ein Kohlenstoffring aus sechs C-Atomen.

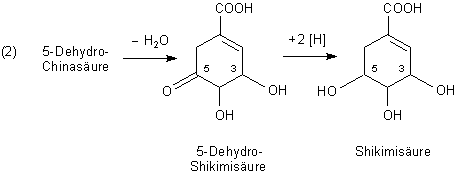
Aus der 5-Dehydro-Chinasäure wird durch Wasserabspaltung 5-Dehydro-Shikimisäure gebildet. Damit entsteht die erste Doppelbindung im Kohlenstoffring. Die 5-Dehydro-Shikimisäure wird anschließend zur Shikimisäure reduziert.
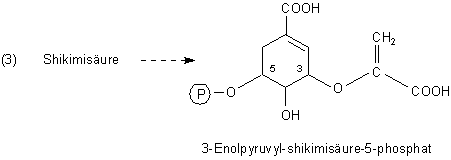
Es folgt Phosphorylierung in der Ringposition 5. In Position 3 wird ein weiteres Molekül 2-Phospho-enolpyruvat gebunden. Es entsteht 3-Enolpyruvyl-shikimisäure-5-phosphat.
Durch Abspaltung von Wasser und dem Phosphatrest bildet sich Chorisminsäure.
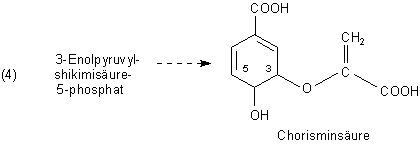
Damit ist in den Ring eine zweite Doppelbindung eingeführt worden.
Die Chorisminsäure ist quasi die „Mutter aller Bio-Aromaten“. Sie ist der Schaltpunkt, an dem sich die Synthesewege aller anderen kohlenstoff-aromatischen Verbindungen abtrennen (griech. chorismos, Trennung).
Beispielsweise wird durch Umlagerung aus Chorisminsäure zunächst die Prephensäure gebildet. Diese wird dehydriert und decarboxyliert. Es entsteht p-Hydroxyphenyl-brenztraubensäure.
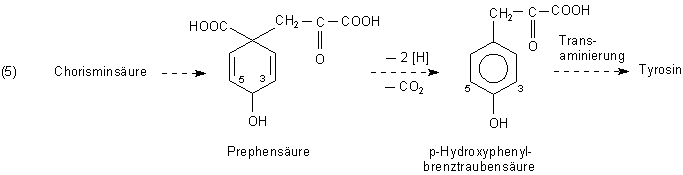
Durch Übertragung einer Aminogruppe entsteht daraus durch Transaminierung mit einer anderen Aminosäure wie Alanin, Glutamin oder Asparagin die Aminosäure Tyrosin.
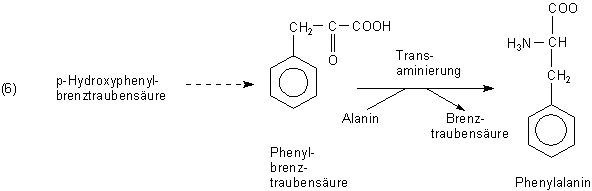
Es kann aber auch die para-ständige Hydroxylgruppe entfernt und die so gebildete Phenylbrenztraubensäure zu Phenylalanin transaminiert werden.
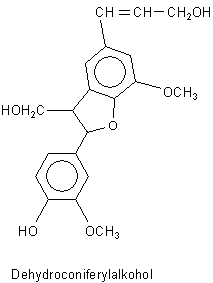
Auch Lignin ist aus dieser Bio-Aromatensynthese hervorgegangen
Man kann meinen, dass Lignin zu den Terpenen gehört. Wenn man sich jedoch den typischen
Ligninbaustein Dehydroconiferylalkohol genauer ansieht, wird einem
deutlich, dass auch dieser auf die Chorisminsäure zurückzuführen ist.
Last but not least
Es muss darauf hingewiesen werden, dass Pflanzen Kohlenstoff-Aromaten auch ausgehend von Isopren über die
Terpene synthetisieren können. Das spielt vor allem eine Rolle bei Verbindungen wie etwa dem Vanillin.
Weitere Texte zum Thema „Kohlenwasserstoffe“