 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1616
F: Wir planen einen Schülerexperimentiertag zum Thema Wärmekissen. Wir haben uns für die
Variante mit Natriumacetat entschieden, die im Versuch auch sehr gut funktioniert. Leider haben wir das Problem der Verpackung,
denn wir würden den Schülern gerne ihr Kissen am Ende des Tages mit nach Hause geben. Meine Frage ist nun, ob Sie das auf Ihrer
Seite abgebildete Kissen selbst hergestellt haben und wenn ja, mit welcher Folie, bzw. welchen Verschlusstechniken Sie gearbeitet
haben?
Ich wäre Ihnen für eine kurze Antwort sehr dankbar, denn die Zeit wird langsam knapp und es wäre sehr schade, wenn das ganze
Projekt an der Verpackung scheitern würde.
A: Die Wärmekissen in unserer Webseite tragen die Aufschrift
www.chemie.com. Ich erinnere mich, dass sie bei den öffentlichen Aktivitäten aus Anlass eines „Jahres der Chemie“ vom VCI und vom
Fonds der Chemie verteilt wurden.
Mit der Herstellung dieser Kissen, die man besser überall (z. B. in Sportartikelgeschäften) kaufen kann, haben wir uns nicht beschäftigt. Uns ging es um die Erarbeitung der physikalisch-chemischen Hintergründe.
Man kann natürlich versuchen, solche Kissen herzustellen. Dazu brauchen Sie mindestens eine Maschine zum Einschweißen von Lebensmitteln, wie sie in vielen Haushalten zu finden ist. Allerdings sind die nur für dünne Folien geeignet.
Erwarten Sie deshalb nicht zuviel davon. Denn diese Kissen sind so empfindlich, dass sie sich bald ohne Anlass selbst entladen.
1617
F: Betreff: Versuch mit Wasserglas (Chemischer Garten)
1618
F: Ich bin ein großer Fan Ihrer Website und habe vor einigen Jahren auch ein paar mal mit Ihnen
korrespondiert. Meine Anfrage: Gibt es eine Möglichkeit, das Sulfit/inkl.freies SO2 im Wein zu entfernen?
Selbst Bio-Wein enthält Sulfit (schauen Sie doch mal auf die Rückseite des Flasche-Etikettes; da steht das ganz klein und verschämt).
Mein Problem ist, dass ich schon nach 1 bis 3 Gläsern Rotwein Kopfschmerzen bekomme; und wie ich recherchiert habe, geht es eine Menge
Leuten ähnlich.
Vielleicht ist es der Schwefel??? Es gab ja schon einige Male in der Chemie-Geschichte, dass sich vermeintlich harmlose Zusätze als
gefährlich herausstellten.
Ich habe die Idee, dass "schwefelfreier" Wein eine echte Marktlücke sein könnte. Normalerweise hält der fertige Wein nicht lange,
wenn er nicht "geschwefelt" wird. Im Idealfall müsste man den Schwefel erst beim Ausgießen aus der Flasche "entfernen".
(Meine Chemie-Kenntnisse sind nach 30 Jahren laborloser Zeit auch nicht mehr so grandios; habe schon meine alten Lehrbücher gewälzt,
aber nichts Spezielles gefunden.)
Ich stelle mir so was wie Silberwolle oder ähnliches vor. Also ein Agens, das das SO2 bindet, aber nicht in den Wein übergeht; bzw.
nur harmlose Ionen abgibt.
A: Die Konzentration beträgt 30-50 mg SO2 auf den Liter fertigen Wein.
Schwefelfreien Wein herzustellen ist kaum möglich, da es dann sehr rasch zu Fehlgärungen kommt. Oder dass, wie Sie selbst sagen, der Wein aus dem Grunde der „Verkeimung“ nicht lange hält. Denn er ist immer von Essigbakterien oder von wilden Hefen bedroht.
Mir ist leider kein Verfahren bekannt, das Sulfitsystem aus dem Wein zu entfernen. Erschwerend ist, dass ein Teil des Sulfits sofort chemisch gebunden wird - auch hier wieder an Carbonylverbindungen und Kohlenhydrate. Natürlich kann man das Sulfit mit Eisen(III) oxidieren - dann aber hat man neue schädliche Stoffe drin, wie z. B. das Eisen(II). Sie könnten daran denken, das SO2 durch Strippen oder Erwärmen auszutreiben. Dann gehen Ihnen aber auch viele flüchtige Geschmacksstoffe und der Alkohol verloren. Das gilt auch für Membrantechnologien.
Vor allem will niemand so richtig das Sulfit entfernen. Denn es hat im Wein noch weitere Funktionen. Z. B. sorgt es dafür, dass gegen Oxidation empfindliche Substanzen stabil bleiben. Das sind oftmals Stoffe, denen der Wein seine Aromanoten verdankt. Nichts ist für einen Weinkenner unerwünschter als der Geschmack nach Oxidationsprodukten wie vor allem den Carbonylverbindungen (Aldehyden und Ketonen) („Luftton“ oder „Alterston“).
1619
F: Meine Freundin und ich haben uns gefragt, warum L-Zucker z.B. L-Glucose synthetisch
hergestellt werden? Da bei natürlichen Zuckern nur die D-Form vorliegt?
A: Es gibt insgesamt acht verschiedene, der Glucose ähnliche Zucker
mit sechs C-Atomen (Hexosengruppe der Aldosen). Die Zucker einer Reihe unterschieden sich nur durch die relative räumliche (sterische)
Stellung der OH-Gruppen. Jede Zuckerart hat ihre spezielle Anordnung. Man sagt, es sind Stereosisomere (Diastereomere). Genau genommen
gibt es doppelt so viele Zuckerarten, also sechzehn: Davon ist jeweils die Hälfte L- und die andere D-konfiguriert. Ihre Moleküle
verhalten sich wie das Bild zum Spiegelbild. Diese Paare nennt man Enantiomere. Ihre Mischung ist ein Racemat. Da sich Bild und
Spiegelbild auch wie die linke zur rechten Hand verhalten, spricht man von chiral aufgebauten Verbindungen. (Wer Genaueres wissen
will, klicke hier.)
Wenn man versuchen wollte, eine einzige, spezielle dieser Zuckerarten auf klassische Weise zu synthetisieren, z. B. ausgehend von Glykolaldehyd durch schrittweise Kettenverlängerung, so würde man nur ein Gemisch aus all diesen 16 Zuckerarten erhalten. Es geht aber, wenn man nach jedem Syntheseschritt eine spezielle Trennung der verschiedenen Diastereomere und Enantiomere vornimmt. Das ist sehr aufwendig und geschieht mit anderen enantiomeren Substanzen. Man spricht von einer Racemattrennung.
Die belebte Natur arbeitet weniger verschwenderisch. Sie setzt zur Synthese Katalysatoren ein, die Enzyme. Diese arbeiten selbst stereospezifisch, denn sie bestehen als Proteine nur aus L-Aminosäuren, sind also chiral. Das gilt ganz besonders für das aktive Zentrum, das aus Aminosäureresten aufgebaut ist. Diese sind so angeordnet, dass sich die Bausteine der Zuckermoleküle vor der Synthese von vornherein räumlich so ausrichten, dass bei der Bindungsknüpfung nur eine Zuckerart und davon auch nur ein Enantiomeres entstehen kann (können?).
Umgekehrt kann die L-Glucose auch nicht verstoffwechselt werden, weil sie nicht in die aktiven Zentren entsprechender Enzyme passt. Sie passiert den Darm, ohne resorbiert zu werden. Dabei hat sie allerdings stark abführende Wirkung. Man nutzt sie deshalb entsprechend in der Medizin, z. B. zur Darmentleerung vor Operationen.
Warum bei der Glucose nur die D-Form und nicht die L-Form eine Rolle spielt, ist ungeklärt. Das gleiche gilt für die L-Aminosäuren. Die Biochemie hätte auch mit L-Glucose funktioniert. Oder mit Enzymen aus D-Aminosäuren. Man nimmt unter anderem an, dass sich im Rahmen der biochemischen Evolution die ersten Biomoleküle an katalytisch wirkenden Oberflächen von chiralen anorganischen Mineralien gebildet haben. Die gibt es. Ein Beispiel: Quarzkristalle bilden zwei Enantiomere. Dabei kam es wohl zu der örtlichen Bevorzugung einer Drehrichtung.
1620
F: Könnten Sie mir sagen, warum Natriumsilicat basisch/alkalisch ist?
A: Sie meinen die alkalische Reaktion, wenn man Natriumsilicat in Wasser löst. Dann zeigt
es eine basische Reaktion. Ich persönlich bevorzuge die Formulierung „alkalisch“ statt „basisch“. Denn die als Wasserglas bekannte
Lösung ist stark ätzend.
Natriumsilicat hat die chemische Formel Na4SiO4 (und dazu noch viele ähnliche wie Na3HSiO4,
Na2H2SiO4 oder Na2SiO3 – usw.). Es ist das Salz einer sehr schwachen Säure
(Kieselsäure H4SiO4) und einer starken Base (NaOH).
In wässriger Lösung reagiert das Anion mit der stärkeren Säure Wasser. Formal können wir schreiben.
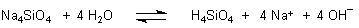
Man spricht von Protolyse. Es werden Protonen von der Säure Wasser auf die Base Silicat-Anion übertragen. Zurück bleiben die Anionen der Säure Wasser; das sind die Hydroxid-Ionen, die typisch für die alkalische Reaktion sind.
Beim Natriumsilicat kommt noch hinzu, dass die zugrunde liegende Kieselsäure in einer Folgereaktion irreversibel in Wasser und in das Anhydrid SiO2 zerfällt (klicke hier), wodurch das Gleichgewicht bei ausreichender Wassermenge immer weiter nach rechts verschoben wird. Ausschlaggebend dafür ist der Energiegewinn bei der Folgereaktion.
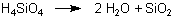
Natriumsilicat reagiert vollkommen analog wie das andere „basische Salz“ Natriumcarbonat (Soda). Kein Wunder, denn die Elemente Si und C stehen in der 4. Gruppe des PSE, in der Gruppe der „Tetrele“ (Frage 1593).
Aber auch Natriumacetat ist hier zu nennen. Dessen korrespondierende Säure dampft beim Lösen teilweise ab. Deshalb riechen Lösungen von Na-Acetat nach Essig.