 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1826
F: Ich habe eine frage an Sie, wieso sind alte Fotos braun? Danke im vor raus für
Ihre Antwort, (…)
A: Da gibt es zwei Möglichkeiten, die teure und die billige:
Die teure Methode beruht auf dem Ersatz von Bildsilber durch Gold. Man legt dazu ein entwickeltes Schwarzweiß-Silberbild in eine Goldsalzlösung. Die Gold-Ionen oxidieren Silber und werden dabei selbst als gelbbrauner Niederschlag ausgefällt:
Ag + Au+ ———> Ag+ + Au
Das ist so, als wenn Sie Zinkmetall in eine Kupfersalz-Lösung legen. Dann bildet sich Kupfer, und Zink geht in Lösung.
Die billige Methode setzt eine Bleichung des Schwarzweiß-Silberbildes voraus. Das macht man zum Beispiel mit Hexacyanoferrat(III), das Silber zu Silber-Ionen oxidiert. Es entsteht ein Bild aus Silber-Hexacyanoferrat(II), das fast unsichtbar ist. Anschließend behandelt man dieses Bild mit einer Natriumsulfid-Lösung. Es bildet sich Silbersulfid, das in der gegebenen Verdünnung gelblich bis braun ist.
1827
F: Ich habe in meinem Garten Küchenschellen. Beim Verkleinern der Stauden habe ich juckende
Hautrötungen bekommen. Was ist da passiert?
A: Die Küchenschelle (Bezeichnung abgeleitet von Kuhschelle)
gehört zu den Hahnenfußgewächsen (Ranunculaceae).
Klick mich an!
Gemeine Küchenschelle (Pulsatilla vulgaris)
(Foto: Blume)
Diese Frühlingsblumen enthalten ein hautreizendes Gift, das Protoanemonin. Chemisch gesehen handelt es sich um ein Furan-on. Man kann es aber auch als einen inneren Ester, ein Lacton, auffassen.
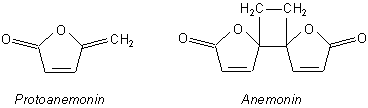
Die (je nach Hauttyp unterschiedlich starke) Giftwirkung ist darauf zurückzuführen, dass die Substanz wegen der aktivierten Doppelbindungen leicht elektrophil mit biochemischen Wirkgruppen reagieren kann. Aber auch an eine Ringöffnung ist zu denken.
Aus diesem Grunde dimerisiert Protoanemonin schon beim Eintrocknen der Pflanzen, wobei ein neuer (wenn auch schwächerer) Giftstoff entsteht, Anemonin. Diese abschwächende Wirkung der Dimerisierung ist wohl der Grund dafür, dass die Kuhschelle Eingang in die Volksmedizin gefunden hat.
Übrigens ist das Protoanemonin auch in anderen Pflanzen enthalten, wie z. B. in der Clematis oder auch in der Nieswurz (Helleborus). Das gilt auch für das Dimere Anemonin, das in verschiedenen Anemonenarten (wie z. B der Anemona pulsatilla) gefunden wird.
1828
F: Betreff: Wieso ist Sandstein rot?
Ein Chemie-Referendar versucht sich die Welt zu erklären und ist einmal wieder gescheitert (vielleicht hätte ich statt Latein eine Naturwissenschaft als Zweitfach studieren sollen).
Auf meiner letzten Rennradtour entdeckte ich eine imposante Wand aus rotem Sandstein und stellte mir die Frage, wo die rote Farbe herkommt. Vom Hörensagen wusste ich, dass die rote Farbe in der Natur in der Regel auf Eisenverbindungen zurückgeht. Nun habe ich herausgefunden, dass Sandstein (wie der Name schon sagt) aus Quarz besteht, die rote Farbe des Sandsteins aber durch Spuren von Hämatit (Fe2O3) entsteht.
Aus dem letzten AC-Praktikum kann ich mich (meine ich) erinnern, dass die Rotfärbung von Hämoglobin auf einem Elektronenübergang von Highspin auf Lowspin des Komplex-Ions beruht, der im sichtbaren Spektrum liegt.
Wie kommt es zur Rotfärbung des Hämatits im Sandstein? Sollte dort auch ein Komplex vorliegen? Wenn ja, welcher? Wenn nein, woher die rote Farbe?
Vielen Dank im Voraus für Ihre Mühen und die super Website sowieso.
A: Sandstein heißt zwar Quarzit, aber das heißt nicht, dass Sand nur aus
Quarz SiO2 besteht. Das ist eine Frage des Materials, das zur Sandbildung zerkleinert worden ist. Sollte der Sand reinweiß
sein (was er selten ist), dann stimmt das wohl. Beispielhaft sind weiße Glassande aus Tertiärgruben. Hierzu gehört auch der (fast)
weiße Sandstein aus Obernkirchen, aus dem das Weiße Haus in Washington erbaut worden ist. Dagegen ist der Sand auf Ceylon oder in
Brasilien oftmals schwarz - aufgrund der Beimischung von den Oxiden der Lanthanoiden oder Actinoiden (Monazitsand) oder
vom Magnetit. Denken Sie auch an die schwarzen Strände von Lanzarote. Klassisch sind aber die
roten Kambrium-Sandsteine des Grand Canyon.
Schauen Sie unbedingt einmal eine „normale“ Sandprobe unter dem Durchlicht-Mikroskop an. Sie entdecken alle möglichen Farben. Sogar lilafarbene Amethysten können dabei sein. Spezialisten können deshalb die Sande den Fundorten zuordnen (wichtig in der Kriminalistik).
Die gelb- bis rotbraunen Anteile der Sandsteine sind oftmals Eisen(III)-silicate. Aber meistens sind es Eisen(III)-oxid-hydroxid-Verbindungen, u. a. auch Limonit und Hämatit. Diese bilden im Sandstein richtige Aggregate - wie das folgende Bild zeigt.
Klick mich an!
Eisenschüssiger Osning-Sandstein (Oberkreide des Teutoburger Waldes)
(Foto: Blume)
Zur Farbigkeit: Eine farbbildende Komplexbildung findet hier nicht statt. (Zur Definition von low-spin und high-spin klicke hier.) Es handelt sich bei der Färbung des Sandsteins in erster Linie sozusagen um „übliche“ Elektronenanregung bei Schwermetall-Oxiden, mit der Folge entsprechender Strahlungsabsorption im Sichtbaren.
PS: Das Weiße Haus wurde, obwohl es aus weißem Obernkirchener Sandstein erbaut wurde, außerdem noch weiß angestrichen. Der Grund war sicherlich der Schutz des weißen Sandsteins gegenüber Umwelteinflüssen.
1829
F1: Betreff: Oberflächenschmelze und Sublimation
Ich bin zeitweise bei der Museumspädagogik beteiligt, wobei junge Menschen spielerisch mit Naturphänomenen experimentieren. Mich interessiert das Verhalten von Eis, das ich in folgendem Zusammenhang nicht verstehe:
1. Eis ist immer mit einem feinen Flüssigkeitsfilm überzogen - Deshalb kann man mit Salz Glatteis bekämpfen.
2. Nasse Wäsche wird draußen im Winter steif, weil das Wasser gefriert. Dann dampft das Eis ab, ohne sich zu verflüssigen. Man sagt, es sublimiert (Email Anfrage Nr. 1648). Die beiden Punkte stammen aus Ihrem Bildungsserver, ich habe die sinngemäß auch oft an anderen Stellen gefunden.
Gibt es nun immer einen Flüssigkeitsfilm auf einer festen Oberfläche? Dann kann es aber doch keine Sublimation geben?! Sehe ich da einen Widerspruch, den es gar nicht gibt, habe ich etwas missverstanden oder übersehen?
Ich würde mich freuen, wenn Sie eine Antwort auf die Frage kennen und sie mir mitteilen. Vielen Dank für Lesen und Nachdenken und Lösen und Beantworten. Ihre Seiten sind prima.
A1: Sie haben sehr gut überlegt.
Aber Sie vergessen, dass man sich bei der formalen Beschreibung/Erklärung dieser Art physikalisch-chemischer Vorgänge nicht um die atomaren/molekularen Dimensionen kümmert. Ob die Sublimation die Folge des Abdampfens des unsichtbaren Flüssigkeitsfilms ist oder ob die Wassermoleküle direkt aus der Festkörperoberfläche stammen, ist letztlich egal. Nach außen hin sieht es immer so aus, als wenn das feste Eis verdunstet (sublimiert) und umgekehrt gasförmiger Wasserdampf ohne Umweg über die flüssige Phase sofort zu festem Eis wird (resublimiert).
Übrigens dürfen Sie sich auch den Übergang von Flüssigkeit zu Eis nicht so streng vorstellen, dass sich sofort das Kristallgitter des Eises ausbildet. Da gibt es zunächst amorphe, „wabbelig“ gelartige bis glasartige, also kristallin ungeordnete Festkörper, deren Umordnung zu einem Kristallgitter sich erst nach und nach einstellt. Das gilt auch für den umgekehrten Vorgang. Wie das abläuft, ist eine Frage der Umgebungstemperatur, der Abkühlungszeit und so weiter.
Zu Ihrem pädagogischen Anliegen: Dass das Eis sublimiert und dass man Eis mit Salz „bekämpfen“ kann, stimmt bekanntlich mit der Erfahrungswelt der Kinder überein. Aber ich würde bei der Besprechung/Erklärung nicht in die molekularen Dimensionen gehen. Das alles können Sie den Kindern nur erklären, wenn sie altersgemäß in der Lage sind, das zu verstehen.
F2: Danke sehr für Ihre rasche Antwort. Damit komme ich gut zurecht. Es ist eine Frage der
Skalierung, der Größenordnung und überhaupt der Modellbildung in bestimmtem Maßstab. Bei einer anderen Skala brauchen wir möglicherweise
ein anderes Modell.
Noch mal ein freundliches Danke für Sie und Ihr Team, das mit Sachverstand und auch Verständnis für mit-menschliches Unverständnis die Freude an natürlicher Wissenschaft vermittelt.
1830
F: Was ist der Unterschied zwischen Manometer und Barometer? Mit beiden misst man doch den Druck.
Warum gibt es da zwei Begriffe?
A: Sie haben Recht: Beide Geräte dienen zur Druckmessung. Es gibt aber einen feinen
Unterschied, nämlich das Bezugssystem zur Messung.
Manometer sind technische Vorrichtungen, mit denen man den Druck relativ zum Umgebungsdruck (meistens Luftdruck) misst. Das macht man zum Beispiel mit Hilfe der Verformung von Membranen. Darauf bezieht sich wohl der Name: Das griechische Wort manos steht für dünn, durchlässig, metron ist das Maß oder der Maßstab.
Ein Barometer (griech. baros, Schwere, Druck) dient ausschließlich zum Messen des Luftdrucks. Es misst den Druck relativ zum Vakuum. Das kann man besonders gut am ersten Barometer von Torricelli sehen, welches vielleicht noch in vielen Schulen zu sehen ist: Hierbei handelt es sich um ein mit Quecksilber gefülltes, unten offenes und oben geschlossenes Glasrohr. Die Hg-Säulenhöhe beträgt bei Normaldruck 760 mm. Über dem Quecksilber bildet sich ein luftleerer Raum aus, das Vakuum. Dazu muss das Glasrohr natürlich in einem „Quecksilbertümpel“ stehen – was das Ganze etwas ungesund macht…
Das heute allgemeine bekannte Wandbarometer, das in vielen Wohnungen hängt, enthält zur Messung statt Quecksilber eine wie ein Gasometer zusammenschiebbare Doppeldose, in deren Innern ein Vakuum herrscht.

Wandbarometer mit besonderem Tiefstand (am 2009-01-23)
(Foto: Blume)