 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1982
F1: Ich weiß nicht ob ich hier an die richtige Mailadresse schreibe und ob sie auch
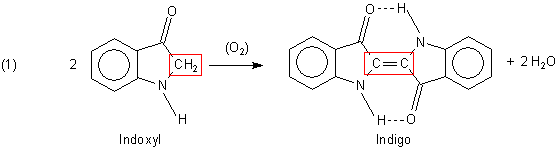
fachliche Fragen beantworten. Für eine Präsentation beschäftige ich mich zur Zeit mit dem Thema Indigo.
Nun meine Frage: Welcher Teil des Indoxyls wird bei der Reaktion zu Indigo oxidiert? Ich habe mir überlegt, dass es das
Kohlenstoffatom ist, welches später zur Doppelbindung wird.
Wenn das so ist welche Oxidationszahl hat dann dies "C-Atom" des Indoxyls und welche das "C-Atom" des Indigos?
A1: Es ist so, wie Sie vermuten. In der Vorstufe Indoxyl liegt eine Methylengruppe
CO-CH2-NH vor, die oxidiert wird, indem zwei H-Atome abgespalten werden.
Die Oxidationsreaktion kann man deshalb auf eine Art formulieren, bei der man sich auf das wirklich Wesentliche beschränkt:
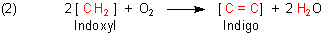
Es macht nun keinen Sinn, eine klassische Betrachtung der Oxidationszahlen zu machen, da das System zu kompliziert ist - vor allem wegen der benachbarten CO- und NH-Gruppe. Zur Herleitung der Oxidationszahlen (OZ) greifen wir deshalb ebenfalls auf die vereinfachte Gleichung (2) zurück.
Eine Änderung der OZ findet nur bei C und O statt, nicht aber bei H.
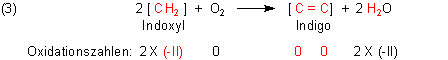
F2: Meine Präsentation über Indigo steht nun kurz bevor und nun stellt sich für noch eine
Frage, wäre super wenn sie mir weiterhelfen könnten!
Beruht die Haftung der Indigomoleküle auf Baumwolle, auf Wasserstoffbrücken zwischen der Carbonylgruppe des Indigos und der
Hydroxylgruppe der Cellulose?! Kann man das so sagen?
Und der Farbstoff Indigo besitzt ja keine hohe Abriebfestigkeit, liegt das daran, dass der Farbstoff durch die Wasserstoffbrücken
nur "mechanisch" an der Faser gehalten wird und die Bindung leicht zu "durchbrechen" ist?
Vielen Dank für Ihre Hilfe.
A2: Die H-Brücken oder deren Ansatzpunkte, mit denen Indigo Bindungen eingehen könnte, sind
durch die das Molekül stabilisierende innere H-Brücke zwischen CO und NH abgesättigt. Deshalb kommen die OH-Gruppen der Glucosereste
der Cellulose kaum oder gar nicht zum Zuge.
Man kann das auch so sagen: Die als H-Brücken-Rezeptoren wirkenden freien (nichtbindenden) Elektronenpaare an O und N sind quasi anders beschäftigt: a) durch interne H-Brücken und b) durch die farbgebende Mesomerie des aromatischen Systems, an dem sie mehr oder weniger direkt/indirekt beteiligt sind.
Vielmehr geht es hier um van der Waals-Bindungen zwischen den planaren C-Gerüsten der Indigomoleküle und dem mehr oder weniger flachen unpolaren C-Gerüst der Glucosereste. VdW-Bindungen beruhen auf Nahordnungskräften und sind deswegen nicht sonderlich stabil. Aus diesem Grunde ist Indigo vor allem bei höheren Temperaturen leicht auswaschbar. Sie sollten übrigens die H-Brücken nicht unterschätzen: die sind um Größenordnungen stabiler!
1983
F1: Es gibt in der Neurobiologie einen Modelversuch mit unterschiedlichen KCl-Konzentrationen
(z. B. 1 mol/l gegenüber 0,01 mol/l) unter Verwendung von Silber- oder Kohlelektroden, mit dem man zeigen kann, dass durch
unterschiedliche K-Konzentrationen innerhalb und außerhalb von Nervenzellen eine Spannung entsteht.
Nach Nernst lässt sich die Spannung zwar berechnen, doch kann ich mir diese mit dem üblichen Wissen elektrochemischer Prozesse von Konzentrations-Halbzellen nicht erklären.
Können Sie mir erläutern, welche Red-Ox-Reaktionen hier ablaufen?
A1: Hier geht es um Membranpotentiale, wie sie auch an Nerven auftreten. Übrigens beruht
auch der Potentialaufbau bei einer Glaselektrode auf den gleichen Vorgängen.
Sie verwechseln da etwas Grundlegendes, nämlich die Abläufe bei einer Elektrolyse und die Vorgänge bei der Messung einer Potentialdifferenz.
Bei der Messung der Potentialdifferenz findet gar kein Redox-Prozess statt. Das darf sogar gar nicht sein: Wenn das so wäre, wäre die Messung wertlos, weil bei einer Elektrolyse (also bei Stromfluss) das Potential zusammenbrechen würde. Das „stromlose“ Messen erreicht man, indem man die Potentiometer durch effektive („unendlich große“) Vorwiderstände stromlos schaltet.
Was Sie als Potentialdifferenz messen, hat seinen Grund in der unterschiedlichen Polarisation auf beiden Seiten der Membran, die von der unterschiedlichen Ionenkonzentration (besser: Ionenaktivität) herrührt. Schließlich sind Ionen ja elektrische Ladungsträger, die unterschiedlich „aktiv“ sind. So sind auch gleichkonzentrierte Lösungen von NaCl und KCl hinsichtlich ihrer Aktivität deutlich unterschiedlich. D. h. konkret: Eine 0,1 M-Lösung von NaCl verhält sich elektrochemisch anders als eine 0,1 M-Lösung von KCl .Das gilt auch für den Vergleich von Anionen und Kationen.
In der Nernst-Gleichung setzt man in den Konzentrationsquotienten die beiden Konzentrationen (besser: Aktivitäten) der KCl („innen“ und „außen“) ein. In verdünnten Lösungen (c < 0,1 mol/l) kann man die Aktivität näherungsweise gleich der Konzentration setzen.
Zum Aktivitätenbegriff lesen Sie hier nach.
F2: Gemeint war ein Analogversuch zum Membranpotenzial, um zu zeigen, dass durch
unterschiedliche Konzentrationen von Metall-Ionen eine Spannung entsteht, wenn die beiden Halbzellen leitend verbunden werden.
Klassisch ist der Batterie-Versuch mit Kupfersulfat und Kupferelektroden.
Dabei laufen folgende Reaktionen ab:
Auf der Seite mit der konz. Lösung: Das 2-fach positive Cu-Kation nimmt 2 Elektronen auf und wird zu elementarem Cu.
Auf der Seite mit der verd. Lösung: Cu gibt 2 Elektronen ab und wird zu einem 2-fach positiven Cu-Kation.
Diese Red-Ox-Reaktionen können aber bei KCl-Lösungen mit unterschiedlicher Konzentration, wie sie innerhalb und außerhalb der Nerven vorliegen, und dann im Modelexperiment nachgestellt werden, nicht erfolgen, wenn als Elektroden Kohle- bzw. Silberstäbe verwendet werde. Außerdem kann sich aufgrund der Überspannung kein Kalium abscheiden. Das verblüffende ist nun, dass trotzdem eine Spannung zu messen ist und auch in der Natur gefunden wird und die kann man problemlos ja auch mit Nernst ausrechen.
Mir ist jedoch nicht verständlich, welche molekularen Prozesse dem zugrunde liegen und bisher habe ich noch keine Lösung für die Beobachtung finden können.
A2: Was Sie beschreiben, ist eine schlichte Konzentrationszelle.
Die beiden Halbzellen sind in der Lösung nur über eine für Ionen durchlässige Membran ionen-leitend verbunden.
Auf jeden Fall schreiben Sie ja selbst, dass der Kupfer-Vergleich nicht passt und in die Irre führt, weil K+ nicht abgeschieden werden kann.
F3: Vielen Dank für Ihre Bemühungen zur Aufklärung des Problems.
Um das Problem anschaulicher zu machen, habe ich Ihnen den von mir durchgeführten Schulversuch beigefügt, bei dem eine Spannung von
-58 mV gemessen wurde.
Mein Seminarleiter sowie ich hätten natürlich gerne eine plausible Erklärung für die Reaktionen, die zu dieser Spannung führen.
Natürlich lässt sich diese vorzüglich über mathematische Formeln ausrechnen, aber damit bleibt das Problem der Reaktionsschemata,
wie sie beim System Cu/Cu-Sulfat möglich sind, weiter bestehen. Auch mein Vater, der in Chemie promoviert hat, findet bisher keine Lösung.
A3: Vielleicht hilft dieses Bild: Es bilden sich an der Innen- und an der Außenseite der Membran
unterschiedlich dicke Ionen-Doppelschichten aus, die ähnlich wie die Platten eines Kondensators mit einem Dielektrikum dazwischen zum Aufbau
von Potentialen führen. Das folgende Bild zeigt eine schematische Darstellung der Ionen-Doppelschichten an einer Glasmembran.
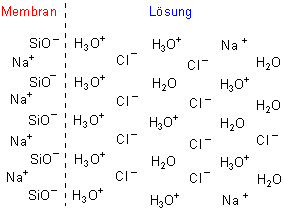
Lesen Sie dazu den Tipp des Monats.
Sie müssen also fächerübergreifend in die Physik schauen, hier in die Abteilung: Elektrotechnik und ganz besonders die der Kondensatoren...
1984
F: Ich habe gerade Schwierigkeiten mit einer Fragestellung die mir sondt immer ganz klar erschien
Gemäß Le Chatelier gilt durch eine Druckerhöhung wird eine Gasreaktion auf die Seite des GG verschoben, auf der die geringere Stoffmenge
an Gasen steht.
(Also z. B.die Ammoniaksynthese oder die Reaktion von Distickstofftetraoxid zu Stickstoffdioxid.)
Andererseits habe ich gelernt, steht es so in Schulbüchern, die Gleichgewichtskonstante ändere sich bei einer Druckveränderung nicht.
Geht das Zusammen? Verschiebt sich das Gleichgewicht, verändern sich im Zähler und Nenner die Partialdrücke bzw. die Konzentrationen, aber doch nicht so, dass dann wieder das gleiche Kc entsteht.
Können Sie dazu etwas erklären? Oder hängt es an der allgemeinen Unzulänglichkeit des Le Chatelierschen Prinzips, das ja doch eher so eine Faustregel ist?
A: Das Prinzip von Le Chatelier ist schon o. k.…
Folgendes wird immer verwechselt - wohl auch Ihr Problem:
a) Die Lage des Gleichgewichts (d. h. die stoffliche Mischung)
und
b) Die Größe der GG-Konstanten.
Erstere kann natürlich durch Druckänderung verschoben werden, aber bei der Verschiebung ändern sich die Konzentrationen der Reaktanden so, dass der Wert der GG-K erhalten bleibt. Lesen Sie hierzu auch die Frage/Antwort 1924.
Dahinter steckt, dass die Gleichgewichtskonstanten unabhängig von den vorgelegten Konzentrationen sind: Verändert man die Konzentrationen der am Gleichgewicht beteiligten Stoffe, so läuft die Reaktion in der Richtung ab, die zur Wiederherstellung des Werts der Gleichgewichtskonstante führt. Hier schreiben wir darüber.
Da bei Gasen der Druck eine Konzentrationsangabe (Stichwort: Partialdruck) beinhaltet, gilt das auch für Druckänderungen. Das erklären wir auf dieser Webseite. Dabei gehen wir auch auf den Unterschied zwischen den Konstanten Kc und Kp ein.
1985
F: Ich habe eine Anfrage hinsichtlich Sicherheit im Chemieunterricht. Von einem Kollegen habe ich
die Idee für einen Demonstrationsversuch für die Reaktion in einem Otto-Motor bekommen (siehe Anhang). Ich bin mir jedoch unsicher, ob
es eventuell zu gefährlich ist, dieses explosive Gemisch in einem Papprohr zu produzieren und in einem Klassenraum anzuzünden.
Kennen Sie sich mit solchen Versuchen aus und können mir weiterhelfen?
A: Der Versuch ist durchaus gängig. Wir beschreiben ihn
im Rahmen einer etwas ausführlicherem Fragestellung (Zündgrenzen von Benzin/Luft-Gemischen) samt
Sicherheitsvorkehrungen (vor allem Gehörschutz!) auf unserer Webseitengruppe zum Thema Technische
Chemie im und ums Auto.
Der Versuch macht Schülern erfahrungsgemäß viel Spaß...