
Eigenschaften und chemische Reaktionen von H2O2
Experimente:
Experimente mit Wasserstoffperoxid
Wasserstoffperoxid ist eine merkwürdige Substanz. Sie ähnelt irgendwie dem Wasser, aber hat
ganz andere Eigenschaften. So sollte man zum Beispiel nie versuchen, mit Wasserstoffperoxid einen
Brand zu löschen. Im Gegenteil, man würde ihn erst richtig entfachen.

(Foto: Blume)
Denn anders als Wasser ist H2O2 äußerst reaktionsfähig und zerfällt
leicht. Dabei bilden sich Radikale, die besonders heftig – teilweise explosiv - weiterreagieren.
Physikalische Eigenschaften
Die reine Substanz ist bei Zimmertemperatur flüssig, farblos und in dicken Schichten wie auch das
Wasser leicht bläulich. Ihr Schmelzpunkt ist fast der gleiche
wie beim Wasser: -0,43 °C. Der Siedepunkt allerdings liegt mit 150,2 °C deutlich höher als der von Wasser.
Grund für dieses Verhalten ist die ausgeprägte Tendenz zur Bildung von intermolekularen Wasserstoffbrücken.
Das gerade macht das Arbeiten mit Wasserstoffperoxidlösungen so gefährlich: Wenn man diese erwärmt, destilliert zuerst das flüchtigere Wasser ab. Die Lösung konzentriert sich zunehmend an H2O2 auf – bis sie dann explodiert. In der Einleitung zu dieser Webseitengruppe haben wir dazu einen Bericht.
Chemische Reaktionen von Wasserstoffperoxid
Im Wesentlichen sind fünf Reaktionsarten zu nennen, an denen sich Wasserstoffperoxid einbringen kann.
Beispiele zu diesen Reaktionen besprechen wir in den folgenden Webseiten, vor
allem aber bei den Nachweisreaktionen für Wasserstoffperoxid.
1. Redoxreaktionen
Gegenüber Reduktionsmitteln (wie MnSO4) wirkt H2O2 als Oxidationsmittel.
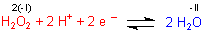
Gegenüber starken Oxidationsmitteln (wie KMnO4) wirkt H2O2 als Reduktionsmittel.
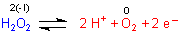
2. Zerfallsreaktion
Normalerweise ist H2O2 stabil, vor allem in Lösung. Man sollte sich aber über eines bewusst sein:
Genau genommen ist die Lösung aber nur metastabil, wartet also wie ein Raubtier auf die Möglichkeit zum Angriff…
Bei schon geringer Zufuhr von Energie neigt die Verbindung zum spontanen Zerfall (Thermolyse). Das ist eine radikalische Reaktion, wobei es zur Kettenreaktion kommen kann. Deshalb erfolgt die Zerfallsreaktion oftmals explosionsartig. Primär bilden sich zwei Hydroxyl-Radikale.
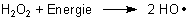
Die Spaltungsenergie ist allerdings sehr hoch: 211 kJ/mol. Aber die Folgereaktionen sind stark exotherm, so dass sich das System im Verlauf der Kettenreaktion zunehmend selbst aktivieren kann. Das bedeutet im Allgemeinen Explosion…
Übrigens bilden sich auch Radikale wie HO2•.
Hydroxyl-Radikale sind vor allem für die Atmosphärenchemie wichtig. Auch an der bodennahen Ozonbildung und an der Bildung des so genannten Ozonlochs sind sie entscheidend beteiligt. Aus ihnen bildet sich umgekehrt auch H2O2, das im sauren Regen nachweisbar ist. Ansonsten sind sie das Putzmittel der Atmosphäre.
Letztlich jedoch ist der Zerfall eine exotherme Redoxreaktion im Sinne einer Disproportionierung.
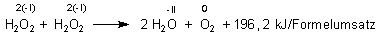
Hierbei wird formal ein H2O2-Molekül reduziert, ein anderes oxidiert.
Diese Zerfallsreaktion wird im Allgemeinen durch Schwermetall-Ionen katalysiert. Aus diesem Grunde fügt man dem H2O2 zur Stabilisierung Komplexbildner oder Phosphate bei, die die Schwermetalle binden. Aber auch Radikalfänger wie bestimmte Alkohole (iso-Propanol) werden zugefügt. Insgesamt wird dadurch der Umgang auch mit 30%igem H2O2 ungefährlicher.
3. Säure/Base-Reaktion
H2O2 ist zwar eine schwache Säure, aber immerhin noch um etwa 4 Zehnerpotenzen stärker als die Säure
Wasser. Das bezieht sich auf die folgenden chemischen Gleichgewichte.
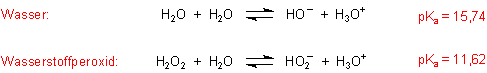
Der pH-Wert (20 °C) einer 30%igen Lösung von H2O2 liegt bei 4, der einer 3%igen Lösung bei 6.
Die Salze von Wasserstoffperoxid sind die Peroxide. Die Peroxide der Alkali- und der Erdalkalimetalle neigen dazu, in Wasser sofort zu hydrolysieren, wobei sich H2O2 und die entsprechende Lauge bilden.
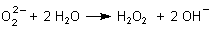
Auf diese Weise stellte man früher Wasserstoffperoxid her (Klicke hier).
4. Komplexbildungsreaktionen
Wasserstoffperoxid bildet nicht nur einfache Salze, wie eben beschrieben. Für manche Metalle wie Titan oder Chrom sowie
Vanadium ist das Peroxid-Ion ein Ligand, der mit dem Zentral-Ion eine Komplexbindung eingeht. Hierbei kommt es keineswegs
zu einer Änderung der Oxidationszahl des Zentral-Ions. Diese Peroxo-Komplexe sind oftmals auffallend
farbig. Darauf beruhen Nachweisreaktionen wie die Blaufärbung des Dichromats oder die
Orangefärbung des Titanylsulfats.
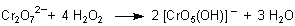
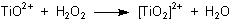
5. Additions- und Peroxoverbindungen
Am bekanntesten ist Carbamidperoxid, die Additionsverbindung mit Harnstoff, das Bleichmittel für
Zähne und Haare. Wir haben dazu eine Webseite.
Aber auch mit anorganischen Substanzen bilden sich Peroxide. Das bekannteste ist wohl das Natriumperborat, das man erhält, wenn man Borsäure, Natronlauge und H2O2 zusammengibt. Es entsteht ein ringförmiges Anion, das aus zwei über eine O-O-Brücke verbundenen Boraten besteht.
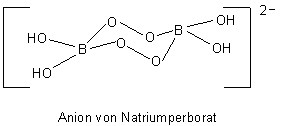
Es ist in fast allen Waschmitteln enthalten, für die nicht ausgesprochen mit Colorschutz geworben wird. Denn beim Lösen in Wasser werden die Zersetzungsprodukte als H2O2, Radikale wie HO• oder HO2• sowie als Sauerstoff freigesetzt. Sie alle wirken zerstörend auf Farbstoffe – vor allem in heißen, alkalischen Waschlaugen.
Von größter Wichtigkeit sind die organischen Peroxide. Sie dienen in der Kunststoffchemie wie zum Beispiel die Peroxobenzoesäure als Startersubstanz für radikalische Polymerisationen.
Weitere Texte zum Thema „Wasserstoffperoxid“