Was ist eigentlich Ammoniak?
Experimente:
Versuch: Nachweis von Ammoniak mit Lackmuspapier
Versuch: Nachweis von Ammoniak mit Salzsäure
Versuch: Austreiben von Ammoniak aus seiner Lösung und
aus seinen Verbindungen
Versuch: Bildung und Zerstörung von
Tetraamin-Kupfer(II)-Komplexen
Ammoniak ist das Hydrid des Stickstoffs, also Stickstoffhydrid. Es hat die
Formel NH3. Seine Struktur ist nicht trigonal planar, sondern tetraedrisch.

Ammoniakmolekül (Quelle: Cornelsen)
Genau genommen handelt es sich um einen Tetraederausschnitt. Verglichen mit dem idealen Tetraeder beim Methan bildet hier ein freies Elektronenpaar die vierte Tetraederspitze. Zur Struktur der Hydride der Elemente der zweiten Reihe des Periodensystems klicke hier.
Ammoniak ist bei Zimmertemperatur ein farbloses, stark ätzendes Gas. Da es aber sehr stechend riecht, kommt es glücklicherweise eher selten zu Unfällen. Die betreffen eher das Austreten des Gases, wenn z. B. jemand unbefugt an seinem Kühlschrank herumfummelt. Denn Ammoniak dient mittlerweile wieder als Kühlmittel. Der Aaskäfer Phosphugaatrata, scheint das zu wissen: Er hält eine 4,5%ige, wässrige Lösung von Ammoniak als chemische Waffe für seine Feinde parat.
Ammoniak ist schon seit dem Altertum in Ägypten bekannt. Die Bezeichnung geht auf den ägyptischen Gott Ammon zurück. Der Name Salmiaksalz für Ammoniumchlorid stammt ebenfalls aus dieser Zeit: Sal ammoniacum.
Grundlegende Verbindungen des Ammoniaks
Mit Säuren verbindet sich Ammoniak zu Ammonium-Salzen (-> Versuch). Das
Ammonium-Ion ist tetraedrisch ausgebaut.
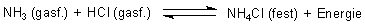
Das ist gleichzeitig ein Beispiel für eine klassische Brönsted-Säure/Base-Reaktion. Ammoniak ist also eine Base.
Es kann aber auch als Säure wirken: Ersetzt man die Wasserstoff-Atome des Ammoniaks durch Metallatome, gelangt man so zu Metallamiden (MNH2), Imiden (M2NH) und Nitriden (M3N), wobei M hier für ein einwertiges Metall steht.
Ammoniak ist also ein Ampholyt. Deshalb findet wie in Wasser auch bei reinem, flüssigen Ammoniak Autoprotolyse statt:
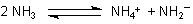
Der Ersatz der Wasserstoff-Atome durch ein, zwei, drei oder vier organische Reste (-R) führt formal zu primären, sekundären, tertiären oder quarternären Aminen.
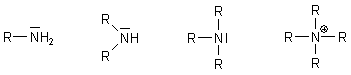
Salmiakgeist - die wässrige Lösung des Ammoniaks
Ammoniak löst sich sehr gut in Wasser. Dies lässt sich anschaulich im Springbrunnenversuch
verdeutlichen. So kann 1 l Wasser bei 20 °C 520 g Ammoniak aufnehmen. Das sind etwa 500 l Gas.
Diese wässrige Lösung des Ammoniaks nennt man Ammoniakwasser. In diesem liegt das in freiem Zustand nicht bekannte Ammoniumhydroxid (NH4OH) vor, das zum Teil dissoziiert, zum Teil als Ammoniakhydrat existiert.
Verdünnte Ammoniaklösungen, im Volksmund auch Salmiakgeist genannt, haben einen Ammoniakanteil von etwa 10 %. Diese Lösung dient auf Grund ihrer alkalischen Eigenschaften als Reinigungsmittel. Salmiakgeist dient auch als alternatives Mittel gegen Insektenstiche.
Diese Wirkung des Ammoniaks rührt daher, dass seine wässrige Lösung Hydroxid-Ionen (OH-) enthält. Auch dies ist das Ergebnis einer Brönsted-Säure/Base-Reaktion.
NH3 + H2O ———> NH4+ + OH-
Salmiakgeist wird auch gerne - im Gegensatz zu fixen Alkalien wie Natriumhydroxid (NaOH) - als flüchtiges Alkali bezeichnet, da bei seinem Erhitzen das gasförmige Ammoniak vollständig entweicht.
Wie stellt man Ammoniak her?
In der Natur entsteht Ammoniak durch anaeroben Abbau von stickstoffhaltigen, organischen Substanzen.
Zudem werden bei der Stickstoff-Fixierung und der Assimilation von Nitraten durch Mikroorganismen elementarer
Stickstoff und anorganische Nitrate in Ammoniak umgewandelt.
Allerdings ist Ammoniak in der Natur selten in freier Form anzutreffen. Es wird meistens rasch in organische Verbindungen (wie Harnstoff oder Harnsäure) überführt oder enzymatisch zu Nitraten oxidiert (Nitrifikation).
Auch im Weltall wurde Ammoniak gefunden, wie zum Beispiel in der Milchstraße und in der Atmosphäre der großen Gasplaneten.
Im Laboratorium stellt man Ammoniak durch Erhitzen von Ammoniak-Wasser oder von einem Gemisch aus Ammoniumchlorid und Calciumhydroxid her.
2 NH4Cl + Ca(OH)2 ———> CaCl2 + 2 NH3 + 2 H2O
Ammoniak war lange Zeit nur aus den Kokerei-Abwässern bei der Stadtgasgewinnung erhältlich. Heute kann man beliebige Mengen mit Hilfe des Haber-Bosch-Verfahrens herstellen. Hierbei werden elementarer Stickstoff und Wasserstoff bei hohem Druck und hoher Temperatur mit Hilfe von Katalysatoren umgesetzt.
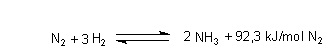
Nach diesem Grundprinzip arbeiten heute alle Ammoniak-Produktionsanlagen der Welt.
Wofür braucht man Ammoniak?
Ammoniak bildet für viele Produkte der chemischen Industrie die Ausgangsbasis für unterschiedlichste
Synthesen. So dient es zum Beispiel zur Herstellung von Harnstoff, Sulfonamiden, Chemiefasern, Natriumcyanid,
Blausäure und Nitrilen, Soda nach dem Solvay-Verfahren, Aminoplasten, Salpetersäure und Nitraten, sowie
in Form der Ammonium-Salze für Düngemittel (vor allem als Ammoniumsulfat) und andere Zwecke.
Flüssiges Ammoniak siedet bei -33,4 °C. Deshalb eignet sich Ammoniak auf Grund seiner hohen Verdampfungswärme (1,26 kJ/g) als Kühlmittel in Kältemaschinen (Kühlschränke).
Auch im Umweltschutz findet Ammoniak Verwendung. So lässt sich Ammoniak zur Entstickung von Rauchgas verwenden.
Wie erkenne ich Ammoniak?
Zunächst ist sein unangenehm stechender Geruch charakteristisch. Das Gas reizt schon in geringen Konzentrationen vor allem
auch die Augen.
Ammoniak färbt als Base Indikatoren um. So erkennt man es an der Bläuung von feuchtem, rotem Lackmuspapier, das man in dem Dampfraum über der Lösung hält (-> Versuch).
Bekannt ist die Bildung von farblosem Rauch (der aus festem NH4Cl besteht) beim Annähern an ein Gefäß, das konzentrierte Salzsäure enthält (-> Versuch).
In wässriger Lösung gibt NH3 bei Zugabe von Kupfersulfat-Lösung die charakteristische, tiefblaue Färbung von Tetraamminkupfer(II)-sulfat ([Cu(NH3)4]SO4) (-> Versuch).
Weitere Texte zum Thema „Ammoniak, Amine und Säure-Amide“