Prof. Blumes Tipp des Monats Januar 2004 (Tipp-Nr. 79)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.

Bild 1 (Foto: Daggi)
Alles um den Winterdienst
Im Winter streut man Salz, um Eis zum Schmelzen zu bringen. Das nennt man "Winterdienst". Viele Leute fragen sich, wie das mit dem Eis und Salz funktioniert. Und deshalb fragen sie auch immer wieder bei mir an.
Zunächst machen wir dazu ein Experiment.
|
Versuch: Eis und Salz
|
 |
| Bild 2 (Foto: Daggi) |
Als Erklärung für die Kinder sollte Folgendes ausreichen: Wenn Salz und Eis
zusammen kommen, will sich das Salz lösen. Dazu muss das Eis erst einmal
schmelzen. Zum Schmelzen braucht es Wärme. Die wird aus der Umgebung genommen.
Die kühlt deshalb ab. Und deshalb gibt es auch unter Null Grad Celsius noch
flüssiges Wasser. (Wenn diese Erklärung aber auch noch zu schwer ist, sollte man
es für die Kinder bei der Demonstration und Beschreibung des Phänomens
belassen!)
Dagegen ist die wissenschaftliche Erklärung für Leute, die es genau wissen wollen, nicht ganz einfach.
Das Experiment hat etwas mit dem Verhalten des Wassers beim Gefrieren zu tun.
Zur Erinnerung: Wenn Wasser abkühlt, verhält es sich merkwürdig. Es zeigt die
bekannte Dichteanomalie: Zunächst nimmt (wie
bei allen anderen Flüssigkeiten auch) sein Volumen ab. Bei 4 °C erleben wir eine
Überraschung: Bei weiterem Abkühlen nimmt das Volumen wieder zu, die Dichte
verringert sich also. Eis ist leichter als flüssiges Wasser. Der Grund ist, dass
sich bei 4 °C die in der Flüssigkeit undiszipliniert herumwuselnden Wassermoleküle
zu sperrigen Kristall-Strukturen zu ordnen beginnen. Die bewirken letztlich, dass
die Struktur von Eis 1/9 mehr Volumen hat als flüssiges Wasser. (Deshalb platzen
Flaschen beim Gefrieren (-> Versuch),
und deshalb schwimmt Eis auf dem Wasser.
Drückt man nun umgekehrt auf das Eis, so schmilzt es (->
Versuch).
Letzteres bringt uns zurück zum Problem: Warum verflüssigt sich Eis, wenn man
Salz darauf streut?
Eis steht nämlich immer unter Druck, und zwar unter dem Luftdruck! Der beträgt
immerhin 1,013 bar. Das ist so, als wenn ein Gewicht mit etwa 1 kg Masse und
einer Grundfläche von 1 cm2 darauf steht (->
Berechnung). Deshalb ist Eis von vornherein immer
von einem feinen Wasserfilm überzogen. Eis und flüssiges Wasser stehen in einem Gleichgewicht.
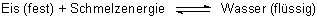
Das darauf gestreute Salz will sich lösen und zieht dazu die feine Wasserschicht vom Eis ab. Die Wasserschicht erneuert sich immer wieder, weil die Luft ja weiterhin auf das Eis drückt. Deshalb löst sich noch mehr Salz, und so geht es weiter. Damit verschiebt sich das o. a. Gleichgewicht nach rechts. Bald ist der ganze Eisblock verflüssigt.
Eis (fest) + NaCl (fest) + Schmelzenergie + Lösungsenergie ———> NaCl-Lösung (flüssig)
Statt des festen Eises und Salzes haben wir jetzt flüssiges Salzwasser. Und das ist bis zu minus 21,6 °C kalt. Damit können wir zwei Fragen beantworten:
1 Warum erreichen wir überhaupt so tiefe Temperaturen?
Wasser kühlt schon beim Lösen von Salz etwas ab. Bei der Kältemischung und beim
Salzstreuen kommt noch die Wärme zum Schmelzen des Eises hinzu. Die nimmt das
Eis aus seiner Umgebung, die deshalb so kalt wird. Auf diese Weise stellt man
ja Kältemischungen her!
Man erreicht aber maximal nur minus 21,6 °C. Bei tieferen Temperaturen ist die
verfügbare Energie zu gering, als dass das o. a. Gleichgewicht verschoben
werden könnte. Deshalb ist unter minus 21,6 °C auch das winterliche Salzstreuen
wirkungslos. (Genau genommen nicht so ganz: Denn von da ab wirken die Salzkristalle
wie Sandkörner auf dem Eis. Die bremsen ja auch ganz schön.)
2 Warum bleibt das Wasser bei diesen tiefen Temperaturen
eigentlich flüssig?
Das flüssige Wasser ist ja jetzt eine hochkonzentrierte
Salzlösung. Darin befinden sich die Ionen des Salzes. Jedes Ion ist von
Wassermolekülen umgeben, und zwar erstaunlich geordnet. In der nächsten Nähe
befinden sich um jedes Ion jeweils 6 Wasserdipole.
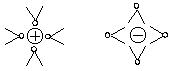
Bild 3: Wasserdipole umgeben in oktaedrischer Symmetrie die Ionen von NaCl.
(Die zwei außerhalb der Zeichenebene angeordneten Wasserdipole muss man sich dazu denken.)
Zur Salz- und Eiskristallbildung müssen die Ionen "gestrippt" werden, das
heißt, ihre Wasserhülle muss abgestreift werden. Das geht nicht so ohne
weiteres! Denn Wassermoleküle sind elektrische Dipole. Die
Ion-Dipol-Wechselwirkungen sind erstaunlich stark. Um die Wassermoleküle von
den Ionen zu trennen, wäre deshalb noch einmal sehr viel Energie aufzuwenden.
Und das schafft das System nicht mehr. Dazu ist es schon zu kalt.
Zur Erinnerung: Diese Vorgänge kennen wir eigentlich schon, allerdings in anderer Ausführung! Bei der Herstellung der Kältemischung sind wir letztlich genauso vorgegangen. Dahinter steckt ja auch physikalisch-chemisch das Gleiche wie beim Winterdienst.
Übrigens ist Salzwasser gar nicht gut für die Umwelt. Auch Brücken zerbröseln, da die Moniereisen im Beton korrodieren. Deshalb verzichtet man auch zunehmend auf das Salzstreuen.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 14. August 2008, Dagmar Wiechoczek