Prof. Blumes Tipp des Monats Oktober 2010 (Tipp-Nr. 160)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Die Blau-Gold-Reaktion
Viele kennen die Reaktion mit dem Farbwechsel zwischen Himmelblau und Orangegelb.
  |
| Bild 1: Blau-Gold-Reaktion (Fotos: Daggi)
Hierzu gibt es einen Film (21,7 MB) Klicke hier |
Obwohl über die Abläufe bei der Reaktion viel spekuliert wird, bleibt doch manche Frage offen:
Ich konnte keinen Beitrag in Ihrem Server zur Blau-Gold Reaktion finden. Hier würden mich die genauen Abläufe interessieren (wieso wird Cu2O erst bei Wärme gefällt? Wieso färbt sich nach Zugabe des Peroxids alles wieder blau und kurze Zeit danach wieder gold-orange?) Ich hoffe Sie können mir weiterhelfen. |
Das Ganze erinnert bei oberflächlicher Betrachtung doch stark an die Fehling-Probe auf reduzierende Zucker oder auf Ascorbinsäure. Der letztere Nachweis ist eine besonders rasch ablaufende Reaktion.
Was aber ist das Reduktionsmittel bei der Blau-Gold-Reaktion?
Hier bringen wir zunächst einmal das Rezept und die Reaktionsanleitung
Bei der Formulierung folgen wir H. W. Roesky *).
|
Versuch 1: Blau-Gold-Reaktion
Durchführung I
Wir machen die Glimmspanprobe. Ergebnis I
Die Glimmspanprobe ist positiv. Durchführung II
Ergebnis II
|
Wie sind die Farbänderungen zu erklären?
Es handelt sich um zwei Reaktionssysteme, die nebeneinander ablaufen:
Zum einen erfolgt die durch Kupfer-Ionen katalysierte Oxidation von Weinsäure/Tartrat durch Wasserstoffperoxid.
Zum anderen geht es um das Redox-System zwischen Wasserstoffperoxid und Kupfer-Ionen.
Die Steuerung des gesamten Reaktionsablaufs erfolgt durch die Temperatur der Reaktionsmischung.
Die Oxidation des Tartrats
Zum Mechanismus der ersten Reaktion gibt es verschiedene Überlegungen. Einmal heißt es, dass Cu(II) in der schwach
alkalischen Lösung (pH-Wert 7,7) das Tartrat oxidiert und dabei selbst zu Cu(I) reduziert wird. Das widerspricht aber
den Erfahrungen bei der Fehling-Probe.
Das so gebildete Cu(I) soll durch Wasserstoffperoxid wieder zu Cu(II) oxidiert werden, wodurch die Tartrat-Oxidation
weiterläuft.
Man meint auch, dass Tartrat simultan durch Wasserstoffperoxid und durch Cu(II) oxidiert wird. Das würde die Bildung
von Cu(I) erklären. Aber Cu(II) oxidiert nicht Tartrat - sonst würde die Fehling-Reaktion nicht funktionieren.
Beide Male fehlt übrigens die Erklärung für den sich in großen Mengen bildenden Sauerstoff.
Das Ganze ist wohl komplizierter,…
… weil nicht Kohlendioxid, sondern Sauerstoff das hauptsächlich gebildete Gas ist. Hinzu kommt ein auffallend großer
Verbrauch an Wasserstoffperoxid. Das spricht dafür, dass mindestens zwei verschiedene Reaktionen ablaufen, die sich
nicht durch einfache Katalysezyklen vernetzen lassen.
Zunächst bilden Cu2+-Ionen mit zwei Tartrat-Ionen den bekannten tiefblauen tartrato-Komplex [Cu(tartrat)2(H2O)2]2-. Zur Struktur des Komplexes klicke hier.
Nach Zugabe von Wasserstoffperoxid gibt es einen Ligandenwechsel:
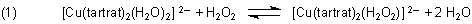
Im H2O2-Komplex läuft die Oxidation von Tartrat unter Bildung von CO2 und Hydroxid-Ionen ab. Offenbar fördern die sterischen Verhältnisse die Reaktion, so dass man sagen kann, dass die Reaktion durch das Cu2+-Ion katalysiert wird. Vergleichen Sie den Reaktionsverlauf auch mit dem analogen Versuch, bei dem statt einer Kupfer- eine Cobalt-Katalyse abläuft.
Formal gilt:
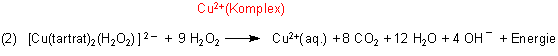
Diese Reaktion muss aktiviert werden. Deshalb ist die Starttemperatur von ca. 50 °C notwendig. Andererseits ist die Reaktion (2) exotherm und heizt die Reaktionslösung auf.
Nun kommt das Redox-Reaktionssystem H2O2 /Kupfer
ins Spiel
Zu allererst müssen wir wissen, dass je nach Umgebung, pH-Wert, Temperatur und Konzentration Wasserstoffperoxid
sowohl als Oxidationsmittel als auch als Reduktionsmittel wirken kann. (Klicke hier.)
Zurück zur Blau-Gold-Reaktion: Ab etwa 75 °C beginnt die Reduktion von Cu(II) zu Cu(I). Reduktionsmittel ist nicht (wie oft vermutet) das Tartrat-Ion, sondern Wasserstoffperoxid. Bei der Reduktion entstehen Sauerstoff und Protonen:
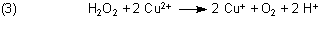
Bemerkenswert ist, dass das entstehende Cu(I) die H2O2-Zersetzung katalysiert. Dieses ist ein Beispiel für eine Autokatalyse. Daher kommt die zunehmend große Menge an Sauerstoff im gebildeten Gas.
Kupfer(I)-hydroxid CuOH ist schwerlöslich und fällt als hellgelber Niederschlag aus.
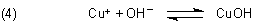
Eine möglicherweise etwas rötliche Färbung des Niederschlags rührt daher, dass sich daneben durch hitzebedingte Wasserabspaltung auch Kupfer(I)-oxid Cu2O bildet.
Man könnte nun mit dem Löslichkeitsprodukt argumentieren.
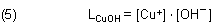
Dazu müsste man jedoch den pH-Wert der Lösung kennen. Wegen der sich ändernden Temperatur ist die Verfolgung der Entwicklung des pH-Werts kaum möglich. Man kann aber Folgendes festhalten: Obwohl die zu Beginn in der Kälte schwach alkalische Reaktionslösung (gemessener pH-Wert 7,7 bei 25 °C) nach der Reaktion wegen der gebildeten Protonen neutral ist (gemessener pH-Wert 6,3 bei 75 °C; das ist der Neutralpunkt bei dieser Temperatur), wird das plötzliche Ausfallen des Niederschlags dadurch gefördert, dass das Wasser-Dissoziationssystem bei hohen Temperaturen mehr Hydroxid-Ionen enthält als bei niedrigen Temperaturen. (Zur Temperaturabhängigkeit des Ionenprodukts des Wassers klicke hier.)
Beim erneuten Zugeben von kalter Wasserstoffperoxid-Lösung zur sich sowieso schon abkühlenden Reaktions-Lösung wird die Lösung rasch wieder blau. Offensichtlich oxidiert Wasserstoffperoxid bei niedrigeren Temperaturen die Cu(I)-Ionen wieder zu Cu(II). Bei der Reaktion entstehen Hydroxid-Ionen, die das System wieder schwach alkalisch einstellen.
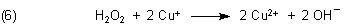
Das anfangs angesprochene Redox-Reaktionssystem zwischen Wasserstoffperoxid und Kupfer-Ionen können wir so zusammenfassen:
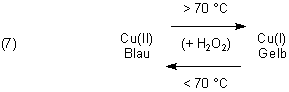
Bleibt die Frage,…
… ob Wasserstoffperoxid Kupfer(II) überhaupt zu reduzieren vermag. Das überprüfen wir mit dem folgenden Versuch.
|
Versuch 2: Fehlingprobe mit Wasserstoffperoxid
Wir mischen 5 ml Fehling I und 5 ml Fehling II in einem möglichst großen Reagenzglas (oder Erlenmeyerkolben; 25 ml) und stellen die tiefblaue Lösung zum Erhitzen in ein kochendes Wasserbad. Nach einigen Minuten geben wir nach und nach tropfenweise so lange Wasserstoffperoxid-Lösung (w = 30 %) (C) hinein, bis die Reaktionsmischung anfängt, sich deutlich umzufärben. Vorsicht! Die Mischung schäumt. Wir machen die Glimmspanprobe. Ergebnis: In der Lösung bildet sich unter starker Gasentwicklung beim Eintropfen gelbbraunes
Kupfer(I)-hydroxid, das sich allerdings wieder auflöst. Erst nach mehrmaligem Zugeben von H2O2-Lösung
erhalten wir bleibendes, tiefrotes Kupfer(I)-oxid.
|

Bild 2: Fehlingprobe mit Wasserstoffperoxid.
Links vor, rechts nach der Reaktion
(Foto: Blume)
Die Blau-Gold-Reaktion ist also letztlich nichts anderes als ein spezieller Fehling-Nachweis mit Wasserstoffperoxid als Reduktionsmittel.
Noch ein Hinweis
Zur Chemie des Wasserstoffperoxids haben wir eine große Webseitengruppe.
Rüdiger Blume
Literatur:
H. W. Roesky und K. Möckel: Chemische Kabinettstücke, VCH, Weinheim, New York; 1994.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 28. September 2010, Dagmar Wiechoczek