 |
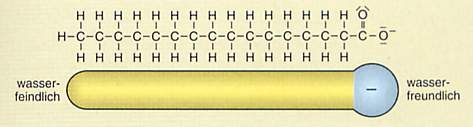
| Dipol einer Fettsäure.
Der unpolare Kohlenwasserstoffrest ist ein wichtiger Bestandteil eines Emulgators (Quelle: Cornelsen) |
Emulsionen: Gemische, die es eigentlich nicht geben dürfte
Experimente:
Versuch: Butter selbst gemacht!
Versuch: Herstellung von Margarine
Versuch: Herstellen von Mayonnaise (Modellversuch)
Versuch: Zerstören von W/O-Emulsionen durch Erhitzen
Es klingt zwar widersprüchlich, aber Emulsionen sind Gemische aus nicht miteinander
mischbaren Flüssigkeiten. Schüttelst du z. B. ein Teil Wasser mit einem Teil Öl,
kommt es zunächst zu einer gewissen Verteilung. Stellst du das Gemisch auf den Tisch und
lässt es einen Moment unberührt, so beobachtest du, dass sich die beiden
Stoffe langsam wieder entmischen, die beiden Phasen bilden sich mehr oder weniger zurück.
Du hast also durch dein Schütteln nicht viel erreicht. Um diese Flüssigkeiten
effektiver zu mischen, hat sich die Natur etwas Besonderes einfallen lassen.
Sie setzt für diese Fälle Emulgatoren ein. Emulgatoren reichern
sich an den Grenzflächen der Fett- und Wassertröpfchen an und richten ihre polaren
Gruppen zum Wasser und die unpolaren zur Fettphase hin aus. Die beiden Phasen werden sozusagen
über einer Brücke miteinander verbunden und stabilisieren so das Gesamtgemisch.
 |
| Dipol einer Fettsäure.
Der unpolare Kohlenwasserstoffrest ist ein wichtiger Bestandteil eines Emulgators (Quelle: Cornelsen) |
Man unterscheidet zwei Arten von Emulsionen, je nachdem welcher Anteil im Gemisch überwiegt:
2. Wasser-in-Fett-Emulsionen (oder Wasser-in-Öl-Emulsionen)
sind Gemische, wo wenig Wasser in viel Fett verteilt ist, z. B. Butter
oder Margarine.
Eine weitere Einteilung erfolgt über die Emulgatoren selbst. So unterscheidet man
natürliche und künstliche Emulgatoren.
Natürliche Emulgatoren sind z. B. Lecithine, die auch als
Phosphatidylcholine bezeichnet werden und in die Substanzklasse der
Phosphatide gehören. Lecithine werden aus Soja- und
Rapsöl oder auch aus Eigelb gewonnen. Ihr chemischer Aufbau ist zunächst
ähnlich dem der Diglyceride, denn im Molekül sind eine primäre und
die sekundäre Hydroxygruppe des Glycerins mit je einer Fettsäure (R1-COOH,
R2-COOH) verestert.
Zusätzlich ist bei Lecithinen die dritte noch freie Hydroxygruppe mit der
Phosphorsäure und diese wiederum mit Cholin verestert.
Die sekundäre Fettsäure im Molekül ist fast immer ungesättigt.
Lecithine sind für den gesamten Zellstoffwechsel von großer Bedeutung, da sie nicht nur als Lösungsvermittler, sondern auch als Transportmittel für Fettsäuren unentbehrlich sind. Das betrifft sowohl deren Transport im Blut als auch durch die Zellwände hindurch. Diese sind nämlich für Triglyceride unpassierbar, für Phosphatide aber kein Hindernis.
Weitere natürliche Emulgatoren sind Sterine - ein sehr bekanntes ist das Cholesterin - sowie Mono- und Diglyceride, die in Speisefetten vorkommen.
Zu den synthetischen Emulgatoren gehören ebenfalls Mono- und Diglyceride, die allerdings chemisch modifiziert werden. Beispiele sind Mono- und Diglyceride von Speisefettsäuren verestert mit Essig-, Milch-, Citronen- oder Weinsäure sowie die Natrium-, Kalium-, Calcium- und Magnesiumsalze der Speisefettsäuren.
Aufgrund ihrer Eigenschaften spielen Emulgatoren in der Lebensmitteltechnologie eine
große Rolle. Sie stabilisieren nicht nur Wasser/Fett- und Fett/Wasser-Emulsionen,
sie erhöhen unter anderem auch die Streichfähigkeit von Margarine und die Luftaufnahme
in Softeis.
Emulgatoren gehören gemäß des Lebensmittel- und
Bedarfsgegenständegesetzes zu den Zusatzstoffen.
Alle Zusatzstoffe werden durch eine E-Nummer gekennzeichnet, beispielsweise verbergen sich
Lecithine hinter der Nummer E 322 und Mono- und Diglyceride von Speisefettsäuren hinter
der Nummer E 471.
Weitere Texte zum Thema „Milch“