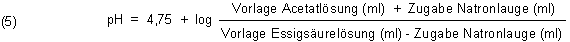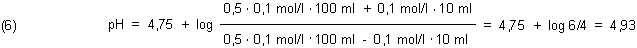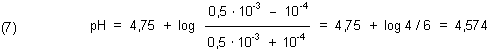Prof. Blumes Tipp des Monats Juli 2008 (Tipp-Nr. 133)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Von Puffern und Pufferung

Bild 1: Was wäre dieser Gefahrgutwaggon ohne die Puffer vorn und hinten? Sicherlich eine
fahrende Zeitbombe!
(Foto: Blume)
Überall begegnen wir Puffern: Jeder kennt die Eisenbahnwagenpuffer. Als es diese
technischen Kunstwerke noch nicht gab, war schon das leichte Abbremsen eines Zuges gleichbedeutend mit
einem heftigen Stoß, durch den die Passagiere in den Waggons herum- oder gegebenenfalls auch aus ihnen
herausgeschleudert wurden. Im Bild sehen wir einen Waggon, der Gefahrgut transportiert. Wenn wir schon dabei
sind: Was überhaupt bedeutet das weiße Schild mit den zwei Ziffern? Klicke hier.
Aus dem Chemieunterricht kennen wir Pufferlösungen. Meere gelten als CO2-Puffer. Ein Pufferstaat trennt zwei feindliche Nachbarn (die sich dann an ihm gütlich tun…). Und dann gibt es noch das einschlägige Etablissement in Vergnügungsvierteln (was hier nicht vertieft werden soll…).
Was ist all diesen Puffer-Beispielen gemeinsam? Schüler auf dem Schulhof wissen es: Puffen ist gleichbedeutend mit Stoßen. Abpuffern dagegen heißt, Stöße abzufangen.
(Nicht zur Wortfamilie gehören übrigens Kartoffelpuffer und Puffärmel. Puffs
heißen auch die aktiven Stellen eines Chromosoms. In diesen Fällen steht das Puffen für Aufblähen. Auch das
altertümliche Wort Puffer für Pistole („Meuchelpuffer“) stammt aus einer anderen Quelle – dieser
Puff war wohl eher lautmalerisch gemeint und beschrieb einen verhaltenen Knall.)
Das Stoßen und Gegenstoßen erfolgt, um das betroffene System im Gleichgewicht zu halten. Die Pufferung ist dann optimal, wenn die einwirkende Kraft so durch aus dem System stammende Gegenkräfte ausgeglichen wird, dass die Auslenkung des Systems minimal gehalten wird. Dabei sollte das Abfangen nicht durch sprunghafte Änderung im System (wie zum Beispiel durch einen Bruch) erfolgen, sondern durch ein kontinuierliches Ausweichen. Man denke an die Knautschzonen beim Auto. Oder an die anfangs erwähnten Puffer an den Eisenbahnwaggons.
Gutes Management einer Pufferreaktion erfordert also die genaue Dosierung der Gegenkräfte. Zur technischen Realisierung greift man zu Regelung und zur elektronischen Steuerung. Auf diese Art und Weise „oszilliert“ das System immer um einen Sollwert herum. Wir sehen, dass Pufferung und Regelungs- sowie Steuerungstechnologien zusammengehören. Ein einfaches Beispiel kennen wir aus dem Labor: Es geht um den Temperaturpuffer, also um den Thermostaten.
Pufferung in der Chemie
Die Vorausberechnung und die Steuerungsmöglichkeiten können wir gut anhand der chemischen Pufferung zeigen.
Wir wollen uns hier in erster Linie mit den Säure/Base-Puffern befassen. Sie bewahren das System
vor überschießenden Säure- oder Baseeinflüssen.
Pufferung ist vor allem für natürliche, mit dem Leben verbundene Vorgänge äußerst wichtig. Bei dem Störfaktor muss es sich nicht mal um einen Stoß handeln, der einem Eisenbahnunglück gleichkommt. So wird z. B. der pH-Wert des Bluts innerhalb enger Grenzen (7,3-7,46) konstant gehalten. Wenn das nicht der Fall ist, gibt es ernsthafte Erkrankungen. Aus diesem Grunde enthält das Blut ein System mehrerer ausgefeilter Pufferungssysteme.
Aber auch im „normalen Chemiealltag“ möchte man möglichst viele Parameter konstant halten, um genaue Aussagen über den Ablauf einer Reaktion treffen zu können. Dazu gehören Temperatur und pH-Wert. So war die pH-Pufferung von Reaktionsmedien der Geniestreich, der es Michaelis und Menten ermöglichte, das erste Mal eine mathematische und dazu auch heute noch anerkannte richtige Beschreibung des Ablaufs von Enzymreaktionen zu veröffentlichen.
Wie wir die Temperatur regeln, haben wir gehört: Mit einem Thermostaten.
Gibt es für die Regelung des pH-Werts auch einen pH-Stat?
Ja, den gibt es. Nehmen wir an, wir hätten eine Lösung, in der eine chemische Reaktion abläuft, in deren Verlauf
Säuren entstehen. Ein Beispiel ist die Esterspaltung.
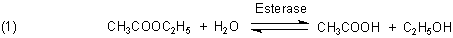
Wenn sich während der Reaktion der pH-Wert verändert, ändert sich auch die Reaktionsgeschwindigkeit. Denn die Esterspaltung ist eine Gleichgewichtsreaktion. Also muss der pH-Wert konstant gehalten werden. Das geht technisch so: Mittels einer protonensensitiven Glaselektrode wird ständig die Veränderung des pH-Werts gemessen. Weicht der vom Sollwert ab, so wird wohldosiert Lauge zugegeben. So bleibt der pH-Wert mehr oder weniger konstant. Genau genommen schwingt er in kleinen Intervallen um den Sollwert.
Wenn man keinen pH-Staten hat, kann man sich eine Pufferlösung mischen
Pufferlösungen stellt man her, indem man eine Säure und ihr Salz in einem bestimmten Verhältnis mischt. Am besten
funktioniert es, wenn man sie im Verhältnis 1:1 zusammengibt.
Bei den puffernden Systemen handelt es sich stets um schwache Säure/Base-Systeme. Diese bilden ein chemisches Gleichgewicht.
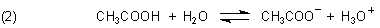
Wenn zu diesem Gleichgewichtssystem irgendeine Säure zugegeben wird, erhöht sich die Konzentration der Protonen bzw. Oxonium-Ionen. Die werden – damit sich wieder ein Gleichgewicht einstellt - von den Anionen geschluckt, wobei sich undissoziierte Säure bildet. Das Gleichgewicht verschiebt sich in die linke Richtung. Geben wir eine Lauge zu, so erhöht sich die Konzentration der Anionen. Das Gleichgewicht verschiebt sich nach rechts.
Das ist doch alles recht einfach, oder?
|
Versuch 1: Herstellung einer Pufferlösung (Acetatpuffer)
|
Mit diesem Puffer können wir schon einiges an Säure oder Lauge abfangen. Machen wir zunächst einmal ein qualitatives Experiment, das heißt ein Experiment, wo es nicht so genau auf das Arbeiten ankommt und das für Anfänger geeignet ist.
|
Versuch 2: Laugenzusatz - mit und ohne Puffer
Wir geben etwa 25 ml der stark verdünnten Salzsäure in ein Becherglas. Dann tropfen wir etwas Natronlauge zu und verrühren gut. In einem zweiten Versuch legen wir statt der Salzsäure die gleiche Menge an Pufferlösung vor. Ergebnis
Beim Acetatpuffer verändert sich der pH-Wert zunächst kaum. Man muss schon einiges an Lauge zugeben, bis der Indikator umschlägt. |

Bild 2: Ergebnis von Versuch 2
(Foto: Daggi)
Nun wollen wir sehen, ob man das auch genauer untersuchen kann. Das heißt, ob man quantitative Aussagen treffen kann.
|
Versuch 3: Quantitative Pufferwirkung
- Wir legen 25 ml Puffer vor und titrieren zunächst mit Natronlauge. Indikator ist Phenolphthalein. - Anschließend titrieren wir in einem neuen Ansatz 25 ml Acetatpufferlösung mit Salzsäure. Mögliche Indikatoren sind in diesem Fall Methylorange oder Methylrot. Ergebnisse
|
Die Menge von 12,5 ml war zu erwarten. Überlegen wir einmal: Wir haben 25 ml eines 1:1-Puffers vorgelegt. Davon bestand die
Hälfte (entsprechend 12,5 ml) aus Essigsäurelösung, die anderen 12,5 ml aus der Lösung des Acetats.
Durch Zugabe von starker, das heißt vollständig dissoziierter Base (Natronlauge) haben wir die Puffersäure aufgebraucht.
Umgekehrt haben wir durch Zugabe von 12,5 ml Salzsäure die Pufferbase umgesetzt.
Dann war Schluss mit der Pufferung: Der Indikator schlug um. Bemerkenswert ist bei diesem Versuch, wie lange nichts zu passieren scheint! Der Indikator wenigstens verhält sich lange Zeit ziemlich still.
Kann man Pufferreaktionen berechnen und so planen?
Wir haben schon gehört, dass es sich bei den Puffern um Gleichgewichtssysteme zwischen Säuren und Basen handelt.
Ohne Übertreibung kann man sagen, dass die Pufferung ein perfektes Anwendungsbeispiel für die Prinzipien
des Massenwirkungsgesetzes ist – und außerdem auch für die Brönstedsche Säure/Base-Theorie.
Gleichgewichte beschreibt man durch eine Konstante.
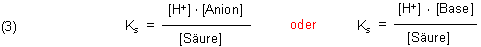
Diese Gleichung für deren Gleichgewichtskonstante wird logarithmiert und umgestellt. So erhalten wir die bekannte Puffergleichung. Sie wird nach den ersten Anwendern Henderson und Hasselbalch benannt. Diese untersuchten die Pufferwirkung des Blutes.
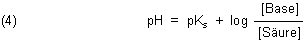
Mit dieser Gleichung können wir gut rechnen. Erst einmal ist pH = pKs, wenn die Konzentrationen von Säure und Base gleich sind. Hier ist auch die Pufferwirkung am größten. Das sind dann die 1:1-Puffer, wie wir sie bislang benutzt haben.
Beispiel 1:
Wenn wir Lauge zugeben, erhöhen wir die Konzentration der Basen. Gleichzeitig verringern wir die Konzentration der Säure um den gleichen Betrag.
Die Konzentration der Säure und der korrespondierenden Base ist jeweils das 0,5fache der Gesamtkonzentration des Puffers.
|
Die pH-Wertänderung von 0,176 ist relativ gering. Sie wird durch die praktische Messung weitgehend bestätigt.
Abweichungen von etwa 0,2 pH-Einheiten resultieren daher, dass wir hier mit echten Konzentrationen rechnen. Die Glaselektrode
misst aber stattdessen die Aktivitäten.
Wir können auch den umgekehrten Fall annehmen, indem wir zu unserem Puffer Salzsäure zugeben. Dann nimmt der pH-Wert um 0,176 ab.
Pufferung ist nicht unbegrenzt möglich
Die Beschäftigung mit Puffern soll das Gefühl vermitteln, dass jegliche Pufferung an ihre Grenzen stößt, wenn die
Einwirkung der Störung zu groß ist. Man spricht von der Kapazität eines Puffers.
Beispiel 2:
Zum Reaktionsende stellt sich also der pH-Wert 4,574 ein. |
Diese Abweichung ist doch recht groß und im Allgemeinen nicht zu tolerieren. Wenn man jedoch den Puffer von vornherein
stärker konzentriert vorlegt, ist natürlich auch seine Wirkung stärker. Bei einem Puffer mit c = 0,01 mol/l erhält man nach
Reaktionsende den pH-Wert 4,733. Bei c = 0,1 mol/l ist der pH-Wert 4,748. Der Fehler liegt dann im Promille-Bereich.
Der Puffer muss also mindestens 1000fach konzentrierter sein als das Protonen oder Hydroxid-Ionen produzierende Reaktionssystem.
Ein anderer, wichtiger Aspekt der Pufferung soll nicht unerwähnt bleiben: Die puffernden Substanzen dürfen nicht an der Reaktion, deren pH-Wert sie konstant halten sollen, beteiligt sein. So darf man biochemische Reaktionen, bei denen Phosphatübertragungen untersucht werden sollen, nicht mit Phosphat puffern.
Um die Theorie der Puffer besser zu durchdringen, sollten fortgeschrittene Schüler oder Lernende die potentiometrischen Titrationskurven von Säure/Base-Systemen hinzuziehen. Dazu haben wir eine Webseite. Da wird auch der praktisch wichtige Begriff der Pufferkapazität genauer erläutert.
Zum Schluss noch eine Anmerkung
Chemische Puffer gibt es auch bei Redoxsystemen. Ein Beispiel ist das Hexacyanoferrat-System.
Biologisch realisiert sind sie in der Atmungskette.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 15. August 2008, Dagmar Wiechoczek