Prof. Blumes Tipp des Monats Juli 2016 (Tipp-Nr. 229)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Womit sich Tiere einfetten – und wie sie das tun…
Rüdiger Blume
Man kann an Vogeltränken beobachten, wie Vögel baden und herumplantschen, dabei aber nicht nass werden. Bild 1: Badende Kohlmeise
Erinnert sei auch an die Wasservögel: Enten und Schwäne stecken beim Gründeln ihren Kopf ins Wasser und ziehen ihn scheinbar trocken wieder heraus. Haubentaucher können sogar minutenlang unter Wasser schwimmen.
Bild 2: Sich einfettende Tafelente
Dass beim Gefieder Fett im Spiel ist, erkennt man an den Spuren, die ein Vogel hinterlässt, wenn er gegen eine Fensterscheibe geknallt ist.
Bild 3: Spuren einer Taube auf einer Fensterscheibe
Wer wie die Kormorane kein Fett zur Federpflege bildet, kann zwar besser tauchen – aber er muss hinterher mühsam sein Gefieder trocknen. Das macht der Kormoran, indem er mit den weit geöffneten Flügeln wedelt.
Bild 4: Kormorane trocknen ihr Gefieder nach dem Tauchen
Bild 5: Schaf auf der Weide
Letztlich trifft das Gesagte auch auf den Menschen zu. Was zum Beispiel kann man gegen schrundige Füße und Hände tun? Pflanzenöl nehmen? Schweineschmalz oder Rindertalg? Das wäre nicht nur eine ziemlich schmierige Sache: Da normale Fette von Bakterien rasch zersetzt werden,
würde man zudem bald ranzig und vor allem nach freien Fettsäuren stinken.
(Foto: Blume)
Was macht das Vogelgefieder so wasserabweisend?
Vögel reiben ihre Federn mit Fett ein. Sie imprägnieren sie quasi. Denn Fette sind bekanntlich wasserabweisend, also hydrophob. Vögel haben eine spezielle Drüse, die Bürzeldrüse. Diese bildet ein fetthaltiges Sekret,
das die Vögel mit ihrem Schnabel auf die Federn verteilen - wie die Ente auf dem folgenden Bild.

(Foto: Blume)
(Foto: Blume)
(Foto: Blume)
Aber auch andere Tiere setzen Fette für ihre Haut- bzw. Fellpflege ein
Dabei machen sie sich zunutze, dass Fette nicht nur Wasser abweisen, sondern auch wärmedämmend wirken und dazu noch Fell und Haut geschmeidig machen. Wie wichtig das ist, wird bei den Schafen deutlich, die auch bei Feuchtigkeit
und Kälte sowie bei Trockenheit und Hitze Tag und Nacht auf der Weide stehen müssen.

(Foto: Blume)
Nicht jedes beliebige Fett ist für die genannten Aufgaben geeignet
Zunächst ist es richtig, dass das Fett zum gleichmäßigen Verteilen auf Federn und Haut sowie im Fell eher etwas flüssig sein muss. Jedoch enthalten fette Öle, wie man sie allgemein kennt, ungesättigte Fettsäurereste.
Die unterliegen bekanntlich der Autoxidation, die zur Vernetzung der Moleküle führt. Das hat zur Folge, dass diese Fette wie Leinölfirnis aushärten, was zum Verschluss der Hautporen und vor allem zum
Verkleben der Federn führt. Außerdem werden fette Öle in der Kälte weniger geschmeidig, ja sogar fest.
Wie behelfen sich die Vögel?
Sie bilden Triglyceride und Wachse mit α-verzweigten Fettsäuren. Das verhindert zunächst die Kristallbildung der Fette. Und da die beteiligten Fettsäuren kaum Doppelbindungen enthalten, entfällt das Risiko der Autoxidation.
Und wie ist das bei den Schafen?
Wie das Bürzelfett der Vögel enthält auch das Wollfett der Schafe Lanolin (lat. lana, Wolle) kaum ungesättigte Fettsäuren. Lanolin ist ein Gemisch von vielen verschiedenen wasserabweisenden Substanzen. (Man spricht von Lipiden.) Der niedrige Schmelzpunkt
des Wollfetts wird zunächst einmal wie bei den Vögeln durch Verzweigung der Fettsäuremoleküle gewährleistet. Interessant ist aber vor allem der Gehalt an "normalen" Fettsäuremolekülen, die weitgehend verestert vorliegen. Glycerin allerdings kommt als Reaktionspartner weniger in Frage. Denn Triglyceride der normalen Fettsäuren sind
(wie beispielsweise in der Margarine) bei tiefen Temperaturen eher fest: Fette können bekanntlich kristallisieren. Das weiß man von altgewordener Schokolade, die raureifartig mit weißen Fettkristallen überzogen ist.
Im Lanolin sind die Fettsäuren mit Steranen wie Cholesterin und Lanosterin verestert. Zur Erinnerung:
Beide Substanzen sind letztlich Alkohole, da sie Hydroxylgruppen tragen. (Im Angelsächsischen spricht man ja auch von cholesterol.)
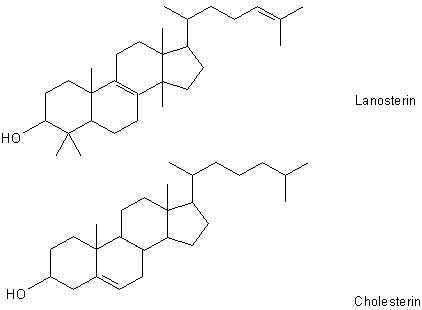
Beim Bürzelfett sind außerdem einige der beteiligten Fettsäuremoleküle zusätzlich endständig verzweigt. Dadurch wird die Kristallisation der Fette weiter erschwert. Sie bleiben deshalb auch bei tieferen Temperaturen flüssig-schmierig. Hinzu kommen noch viele andere Verbindungen, wie zum Beispiel langkettige,
verzweigte Alkohole, die insgesamt quasi als Weichmacher die Fettkristallisation stören.
Die Kristallisation wird zusätzlich dadurch gestört, dass einige Fettsäurereste dazu noch in α-Stellung Hydroxyl-Gruppen tragen. Das hat auch zur Folge, dass das Wollfett sogar etwas hygroskopisch ist. Letztlich ist das Wollfett eine recht stabile Emulsion. Das verhindert die
Austrocknung des Schaffells.
Nicht unerwähnt bleiben soll, dass ein weiterer, großer Vorteil dieses ungewöhnlichen Aufbaus der Moleküle ist, dass Bakterien diese Lipide nicht so leicht wie normale Fette (Triglyceride) angreifen können. Deshalb gibt es auch auf längere Zeit keine Geruchsbelästigung.
Alle diese Substanzen fallen bei der Verarbeitung während der Reinigung von Schurwolle an und werden nicht etwa als Abfall entsorgt, sondern sind geschätzte Rohstoffe zur Herstellung von hochwertigen Hautcremes und Lotionen wie von Nivea®.
Und wenn in den eher fettigen Hautpflegemitteln ein stärkerer Feuchtigkeits-Effekt gewünscht ist, fügt man Glycerin oder Harnstoff hinzu. (Letzterer wird vornehm „Urea“ genannt – denn wer will sich schon ein Produkt,
das vermeintlich aus „Pipi“ hergestellt wird, auf die Haut schmieren…) Beide Substanzen zeichnen sich dadurch aus, dass sie hygroskopisch sind, also Luftfeuchtigkeit an sich ziehen und damit indirekt die Haut mit Feuchtigkeit versorgen.
Zum Schluss ein Hinweis
Das Vorliegen von Steranverbindungen im Wollfett kann man gut mit klassischen Reaktionen nachweisen. Diese nach Salkowski oder nach Liebermann-Burchard benannten Farbreaktionen sind sehr schön, erfordern jedoch den Einsatz von einigen Tropfen Chloroform. Eine erfordert zusätzlich sogar Essigsäureanhydrid.
Das sind alles Substanzen, deren Verwendung in der Schule leider nicht mehr erlaubt ist. Zur Information seien die Vorschriften jedoch gebracht, da sie früher bis in die 1960er Jahre in der Klinischen Cholesterin-Analytik durchaus gebräuchlich waren:
Versuchsgruppe: Klassische Nachweisreaktionen für Sterine [1]
A. Nachweis nach Salkowski
Eine kleine Probe Cholesterin oder Wollfett löst man in 1 ml Chloroform. Man unterschichtet vorsichtig mit einigen ml konzentrierter Schwefelsäure (C). Nicht schütteln! Die Chloroform-Lösung wird tiefrot, die Schwefelsäure zeigt eine grünliche Fluoreszenz.
B. Nachweis nach Liebermann-Burchard
Eine kleine Probe Cholesterin oder Wollfett löst man in 1 ml Chloroform und fügt 0,5 ml Essigsäureanhydrid hinzu. Man tropft zur Lösung vorsichtig etwas konzentrierte Schwefelsäure (C). Die Chloroform-Phase wird anfangs rot, dann blau und färbt sich zum Schluss grün.
Literatur:
[1] Experimente nach: Physiologisch-Chemisches Praktikum. Manuskript des Physiologisch-Chemischen Instituts der Universität Tübingen 1964.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 28. Juni 2016, Fritz Meiners