Ein erster Überblick:
Was die Zitrone wertvoll macht: Das Vitamin C
Experimente:
Versuch: Säuren als Antioxidationshilfsmittel
Versuch: Nachweis von Vitamin C mit Silbernitrat-Lösung (Tollens Reagenz)
Versuch: Nachweis von Vitamin C mit Fehling-Lösung
Versuch: Nachweis von Vitamin C mit Benedict-Reagenz
Versuch: Nachweis von Vitamin C mit Lugol-Lösung
Versuch: Nachweis von Vitamin C neben reduzierenden Zuckern
Versuch: Nachweis von Vitamin C mit Tillmanns Reagenz (DCPIP);
Indikatoreigenschaften von DCPIP
Versuch: Quantitative Bestimmung von Ascorbinsäure mit Kaliumiodat
Das Vitamin C ist wohl das bekannteste Vitamin und zugleich auch dasjenige, von welchem wir
(wie übrigens auch das Meerschweinchen) die mit Abstand größte Tagesmenge benötigen
(70-100 mg). Da der menschliche Körper definitionsgemäß selbst keine Vitamine produzieren
kann, müssen wir das Vitamin C mit der Nahrung aufnehmen. Glücklicherweise kommt es in
relativ großen Mengen in Citrusfrüchten, Hagebutten, Erdbeeren, Kartoffeln, Kohl (z. B.
Sauerkraut), Bananen, vor allem aber in Paprika und Petersilie vor. Um den großen Bedarf der
Pharmazie/Medizin und vor allem der Lebensmittelindustrie sicherzustellen, wird Vitamin C
heute in großen Mengen biotechnisch mit Hilfe von Mikroorganismen aus Glucose hergestellt.
Die chemische Bezeichnung für Vitamin C lautet Ascorbinsäure. Dahinter steckt die Abkürzung
für Antiskorbutische Säure. Denn Vitamin C schützt vor einer früher weit verbreiteten
Vitaminmangelkrankheit, dem Skorbut. Bis ins 19. Jahrhundert erkrankten viele Seeleute daran,
weil sie viele Monate mit ihren Schiffen auf See waren und häufig keinen ausreichenden Vorrat
an frischem Obst und Gemüse an Bord hatten. Später achteten die Kapitäne und Schiffseigner darauf,
dass genügend Vitamin C in seiner klassischen Verpackung dabei war: Sie bunkerten kistenweise Zitronen
und verabreichten jedem Mann täglich mindestens die Hälfte einer dieser Früchte.
In der Lebensmittelindustrie wird Vitamin C häufig als Konservierungsmittel eingesetzt.
Zunächst einmal reagiert Ascorbinsäure sauer und wirkt dadurch antimikrobiell. Vor allem aber
ist die Ascorbinsäure ein starkes Reduktionsmittel und verhindert dadurch die Oxidation der
Lebensmittel durch den Luftsauerstoff. Diese Oxidation macht sich bei geschnittenem Obst durch
eine unansehnliche Bräunung bemerkbar. Durch Zusatz von Ascorbinsäure zu Obst kann man
diese Reaktion unterbinden (-> Versuch).
Struktur und Reaktionen der Ascorbinsäure
Folgt man der Nomenklatur der IUPAC (International Union of Pure and Applied Chemistry),
so darf man den Apotheker nicht nach Vitamin C oder nach Ascorbinsäure fragen, sondern nach
{(R)-5-[(5)-1,2-Dihydroxyethyl]-3,4-dihydroxy-5H-furan-2-on}
Man ahnt, dass es sich beim Vitamin C (wie bei allen Vitaminen) um einen kompliziert aufgebauten Stoff handelt.
In dieser Webseite wollen wir nur das für eilige Leser Wichtigste zur Charakterisierung dieser
Verbindung ansprechen. Genauer auf die Struktur und die funktionellen Gruppen wird in den anderen
Webseiten zur Ascorbinsäure eingegangen.
Wenn du dir die Strukturformel ansiehst, wirst du feststellen, dass der Aufbau der Ascorbinsäure
an einen Zucker erinnert. Daraus wird sie schließlich auch synthetisiert.
Obwohl sie sauer reagiert, gehört sie nicht zu den Carbonsäuren, da sie keine Carboxylgruppe
besitzt. Diese Gruppe ist in dem Molekül als innerer Ester (Lacton) versteckt. Für den sauren
Charakter der Verbindung sind die beiden Hydroxyl-Gruppen links und rechts von der
Doppelbindung verantwortlich. Man spricht hier von einem Endiol.

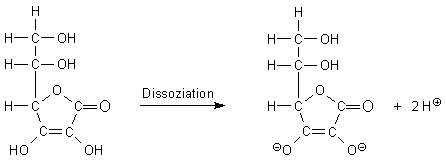
Genau genommen dissoziiert die Ascorbinsäure deutlich in zwei Stufen. Sie bildet deshalb zwei Reihen von Salzen mit den Anionen Hydroascorbat AscH- und Ascorbat Asc2-. Im so genannten physiologischen pH-Bereich um 7 liegt sie vollständig als einstufig dissoziierte Säure, also als AscH--Anion vor. Darüber berichten wir in einer gesonderten Webseite.
Eine weitere wichtige Eigenschaft der Ascorbinsäure ist die, dass sie sehr leicht zu oxidieren ist. Ascorbinsäure ist also ein relativ starkes Reduktionsmittel. Auch hier ist die Endiol-Gruppe von entscheidender Bedeutung. Dabei entsteht die gelblich gefärbte Dehydroascorbinsäure.
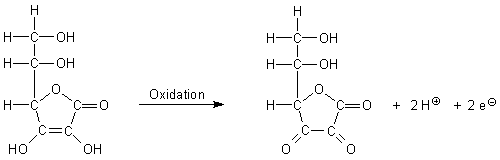
Das Gleiche in Kurzschreibweise:
AscH2 ———> Ascox + 2 H+ + 2 e-
Auch diese Reaktion läuft zweistufig ab. Dabei können sogar Ascorbinsäure-Radikale auftreten.
Diese leichte Oxidierbarkeit ist die Grundlage für die komplizierten chemischen Reaktionen im Organismus, die die Bedeutung von Vitamin C ausmachen. Andererseits ist Vitamin C deshalb auch besonders wenig stabil gegenüber Luftsauerstoff. Frisches Obst und Salate sollte man deshalb bald essen!
Nachweisreaktionen für Vitamin C
Man nutzt die leichte Oxidierbarkeit auch zum Nachweis von Vitamin C. Dazu versetzt man
eine Vitamin C-haltige Probe mit einer Substanz, die sich leicht reduzieren lässt und die dabei die
Farbe ändert. Bei allen Reaktionen wird die Ascorbinsäure (AscH2) zur Dehydroascorbinsäure
(Ascox) oxidiert und die Reagenzlösung reduziert.
Für diesen Nachweis eignet sich zum Beispiel eine Iod/Kaliumiodid-Lösung (Lugolsche
Lösung). Diese wird entfärbt (-> Versuch).
AscH2 + I2 ———> Ascox + 2 H+ + 2 I-
Fehlingsche Lösung (-> Versuch) und Benedict-Reagenz (-> Versuch) enthalten komplex gebundene Kupfer(II)-Ionen in alkalischer Lösung. Sie bilden bei Vorliegen von Ascorbinsäure gelbe bis orangerote Niederschläge.
AscH2 + 2 Cu2+ + 4 OH- ———> Ascox + Cu2O + 3 H2O
Tollens Reagenz ist ammoniakalische Silbernitratlösung. Bei der Nachweisreaktion bildet sich ein schwarzer Niederschlag von Silber (-> Versuch).
AscH2 + 2 [Ag(NH3)]+ ———> Ascox + 2 Ag + 2 NH4+
Tillmanns Reagenz ist das blaue Natriumsalz von Dichlorphenolindophenol (-> Versuch). Den Namen des Reagenzes kürzt man mit DCPIP ab. Die blaue Lösung wird entfärbt.
AscH2 + DCPIP- + Na+ + H2O ———> Ascox + DCPIPH3 + Na+ + OH-
Da die Reaktion quantitativ abläuft und das molare Mengenverhältnis der Reaktanden 1 : 1 ist, beruht auf der Reaktion mit DCPIP eine quantitative Bestimmungsmethode für Vitamin C. Allerdings ist es schwierig, DCPIP-Lösungen einzustellen, da die Substanz unterschiedliche Wassermengen enthalten kann.
Man mag einwenden, dass die vorgestellten Reagenzien nicht nur auf Ascorbinsäure, sondern auf alle oxidierbaren Inhaltsstoffe ansprechen. Zumindest beim Nachweis mit Fehlingscher Lösung und Benedict-Reagenz braucht man nicht zu erhitzen, da diese Nachweisreaktionen mit Ascorbinsäure bereits in der Kälte ablaufen (-> Versuch). DCPIP ist unter diesen Verhältnissen ebenfalls spezifisch.
Eine weitere quantitative Bestimmungsmethode für Ascorbinsäure ist die Iodat-Titration (-> Versuch). Der Redoxprozess ist
IO3- + 3 AscH2 ———> I- + 3 Ascox + 3 H2O
Den Überschuss an Iodat erkennt man daran, dass dieses mit Iodid-Ionen unter Iodbildung reagiert.
IO3- + 5 I- + 6 H+ ———> 3 I2 + 3 H2O
Wegen der leichteren Erkennbarkeit des Umschlags (Iod-Stärke-Reaktion) und der genau einstellbaren
Titrierlösungen wird diese Bestimmungsmethode im Allgemeinen derjenigen mit DCPIP vorgezogen.
Völlig analog verläuft auch die Bestimmung mit Bromat. Den Endpunkt der Titration erkennt
man, indem man einen Farbstoff zufügt, der durch Brom entfärbt wird.
Die Ascorbinsäure ist ein Beispiel für eine Säure, die als Reinstoff in fester Form vorliegt. In dieser Eigenschaft gleicht sie vielen anderen organischen Säuren wie zum Beispiel der Citronensäure. Ascorbinsäure kristallisiert in monoklinen Nadeln oder Plättchen. Unter polarisiertem Licht zeigen die Kristalle ein schönes Farbenspiel.
 |
| Ascorbinsäure-Kristalle in polarisiertem Licht
(Foto: Dr. Martin Büchner, Spenge) |
Wenn man mehr über das Vitamin C wissen will: Zu diesem Thema bieten wir eine große spezielle
Webseite an.
Weitere Texte zum Thema „Zitrone“