Prof. Blumes Tipp des Monats April 2014 (Tipp-Nr. 202)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Goldgewinnung
Es ist wieder Zeit für die Mineralien- und Fossilienbörse. Da gibt es für wenig Geld Goldmineralien zu kaufen.
Klick mich an!
Bild 1: Elementares Gold auf Quarz
(Foto: Blume)
So ein Mineralienstück ist immer noch etwas Besonderes. Denn Gold war und ist immer noch mehr als nur Materielles:
Es ist Symbol für die Sonne und für das Feuer, aber auch für Macht und Reichtum.
Gold heißt auf lateinisch aurum. Daher kommt auch das chemische Symbol für Gold: Au. Wer das weiß, hätte bei Günther Jauch die Frage, wie man Amrum durch Änderung eines Buchstabens vergolden könnte, leicht beantworten können.
Sind in der Schule Experimente zur Goldgewinnung machbar?
Jein.
Zunächst einmal ist Gold teuer. Aber man muss ja nicht unbedingt den elterlichen Schmuck oder Vaters Münzsammlung
verwenden. Es gibt wohlfeil Blattgold zu kaufen. Dieses nutzen z. B. Restauratoren. Vielleicht haben die ein paar
Reste herumliegen, die sie Ihnen abgeben wollen.

Bild 2: Blattgold
(Foto: Blume)
Das Problem mit den möglichen Experimenten zur Goldgewinnung liegt woanders. Wie wir gleich sehen werden, benötigt man
dazu Gefahrstoffe, die in der Schule nicht mehr genutzt werden dürfen. Deshalb nehmen Sie diesen Tipp wieder einmal als Info,
wie es sein könnte, wenn man experimentieren dürfte. Wir haben früher als Schüler diese Experimente selbst gemacht oder vorgeführt
bekommen und haben das - wie Sie sehen - unbeschadet überstanden.
Wie und wo Gold vorkommt
Gold tritt in der Natur in zwei Formen auf:
1. Elementar, also metallisch. Man nennt es Gediegenes Gold.
2. Gebunden in seltenen Mineralien, vor allem mit Tellur. Ein Beispiel ist das Goldtellurid AuTe2, bekannt als Calaverit. Diese Erze spielen aber keine große Rolle.
Entstanden sind Gold bzw. Goldmineralien wie der Begleiter Quarz durch hydrothermale Anreicherung, also unter dem Einfluss von Hitze und Wasser. Auch im ebenfalls hydrothermal entstandenen Pyrit ist Gold zu finden - merkwürdigerweise sieht Pyrit ja aus wie Gold („Katzengold, Fool´s Gold“). Man spricht dann von primären Lagerstätten und von Berggold.
Wenn die Primärmatrix verwittert, wird das gediegene Gold freigesetzt und sammelt sich in Sekundärlagerstätten an. Man nennt es dann Seifengold. Es besteht aus feinen Flittern oder auch aus größeren Goldkörnern, den sagenhaften „Nuggets“. Auch Wagners „Rheingold“ ist letztlich hier einzuordnen…
Weiteres Gold fällt an, wenn die bei der elektrolytischen Raffination von Kupfer oder Silber anfallenden Anodenschlämme aufgearbeitet werden. Hinzu kommen die Verfahren zum Recycling von ausgedienten EDV-Anlagen (usw.). Das sind letztlich auch sekundäre Lagerstätten.
Wie gewinnt man Gold?
Das Goldmineral in Bild 1 stammt aus Tschechien. Wie zu vernehmen ist, soll dort wie früher wieder Gold abgebaut werden. Die
Anwohner sind darüber nicht glücklich, denn sie befürchten Umweltschäden - wie man es in Rumänien gesehen hat oder im Amazonasgebiet.
Warum das so ist, beschreiben wir in den folgenden Abschnitten.
1. Gold aus sekundären Lagerstätten
In Flüssen, die ihren Ursprung in kristallinen Gebirgen wie den Alpen haben, liegt Gold in den Flusssedimenten vor. Bei der
Goldwäsche kann man es abtrennen, indem man in flachen Schalen (Goldpfannen) den
leichteren Sand durch Umschwenken ausspült. (Die Dichte von Gold beträgt 19,32 g/cm3, die von Sand etwa 2,7.)
Damit entgehen einem aber die feinen Goldflitter und Goldstäube. Um diese abzufangen, nutzte man früher ein nicht entfettetes Schaffell. Man leitete die goldhaltigen Schlämme und Gewässer darüber. Die feinen Goldflitter blieben im Wollfett hängen. Letztlich ist das eine Adhäsion. Darauf beruht die griechische Sage von Iason und dem Goldenen Vlies.
|
Versuch 1: Adhäsion von Gold
|
Man kann das feinverteilte Gold auch mit Königswasser herauslösen. Das Verfahren ist heute jedoch nicht mehr gebräuchlich, vor allem auch, weil man das gebildete Goldsalz wegen der starken Säure nicht ohne weiteres abtrennen kann.
|
Versuch 2: Gold wird durch Königswasser zersetzt
|
Beim Amalgamverfahren wird goldhaltiger Boden mit Quecksilber geschüttelt und das Gold extrahiert. Denn Quecksilber vermischt sich sehr gut mit Gold; es bildet sich Amalgam, eine lösungsähnliche Legierung.
|
Versuch 3: Goldamalgambildung
|
Man destilliert das Quecksilber ab und erhält einen Goldrückstand. In primitivster Form wendet man das praktisch zum Beispiel im Amazonasgebiet an. Die Folgen für die Umwelt kann man sich vorstellen.
2. Gold aus primären Lagerstätten
Die Gold führenden Quarzgänge werden bergmännisch abgebaut und in einer „Pochmühle“ staubfein zerkleinert. Man kann den Staub
zunächst wie beschrieben mit Quecksilber extrahieren.
Das meist genutzte Verfahren ist jedoch die 1887 erfundene Cyanidlaugerei. Dazu wird der goldführende Schlamm mit Kalium- oder Natriumcyanid-Lösung aufgeschlämmt. Man leitet anschließend Luft hindurch.
|
Versuch 4: Cyanidlaugerei
|
Dabei wird das Gold oxidiert; es bildet sich der gut in Wasser lösliche, farblose Komplex Dicyano-aurat(I).
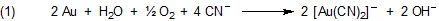
Was ist der Grund für die leichte Oxidierbarkeit von Gold in Gegenwart von Cyanid-Ionen? Das Redoxpotential von Sauerstoff ist mit E°(O2/H2O) = +1,23 V doch kleiner als das von Gold, so dass Gold durch Sauerstoff nicht angegriffen werden kann.
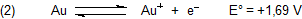
In einer Lösung, die Cyanid-Ionen enthält, verringert sich das ursprüngliche Redoxpotential des Goldes durch die Bildung des sehr stabilen Dicyano-aurat(I)-Komplexes um 1,49 V.
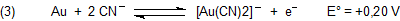
Grund: Die Komplexbildung ist exotherm. Genau genommen ist sie exergon, d. h. es wird "Gibbssche Freie Energie" (ΔG) freigesetzt. G ist direkt proportional zum Standardpotential E°. Das gilt auch für die Differenzen.
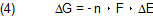
(n ist die Zahl der übertragenen Elektronen, F die Faraday-Konstante und ΔE die Änderung der Spannung.)
Diese zusätzliche Freie Energie senkt deshalb das Redoxpotential des Edelmetalls, so dass es nun vom Sauerstoff leicht oxidiert werden kann. (Analoges gilt auch für das Bleichen von Silberfotos durch Hexacyanoferrat(III) im Verlaufe der Farbfoto- und Dia-Herstellung.)
Mit der Cyanidlaugerei werden auch die beim Recycling von EDV-Anlagen anfallende vergoldete Teile (siehe Bild 3 weiter unten) aufgearbeitet. Des weiteren werden Halden von geröstetem Pyrit mit Cyanidlauge berieselt. Auf diese Weise wird in den USA eine große Menge an Gold gewonnen.
Zementieren und Raffinieren von Gold
Um das in der Cyanidlauge gelöste Gold abzutrennen, gibt man zu den Goldsalzlösungen Zinkstaub. Das Verfahren kennen
wir schon von der Kupfergewinnung als Zementation.
|
Versuch 5: Zementation von Gold
|
Das unedlere Zink reduziert den Goldkomplex. Dabei entsteht der Tetracyanozinkat(II)-Komplex, und das reine Edelmetall fällt als Schlamm aus.
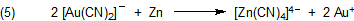
Der Goldschlamm wird abfiltriert.
Auch dieses Verfahren ist äußerst umweltschädlich, da die Abwässer stark cyanidhaltig sind. Das war vor allem vor kurzem in Rumänien der Fall, als es zu Dammbrüchen kam und weite Bereiche sowie Flüsse bis in die Donau vergiftet wurden.
Reinigen (Raffinieren) von Rohgold
Das wie beschrieben auf vielerlei Art und Weise gewonnene Rohgold enthält noch viele andere Metalle - edlere und unedle. Es muss
noch elektrolytisch raffiniert werden. Dazu wird das unreine Gold zunächst geschmolzen und zu Rohgoldbarren
gegossen. Im Elektrolysebad wird es als Anode geschaltet. Die Kathode ist ein Stab von reinstem Gold. Elektrolyt ist eine Goldsalzlösung.
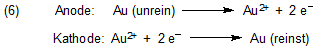
Im Anodenschlamm der Elektrolyseanlage finden sich die noch edleren Platinmetalle. Unedlere Metalle verbleiben in der Lösung.
Dieses Verfahren kann man leicht anhand von Kupfer demonstrieren (-> Versuch).
Verwendung von Gold
Bei Gold denkt jeder an Goldschmuck oder an Goldmünzen. Dazu wird tatsächlich das meiste Gold verwendet.
Klick mich an!
Bild 3: Goldmünzen
(Foto: Blume)
Auch heute noch stützt man mit Goldreserven nationale Währungen.
Viel Gold wird auch von Zahnärzten verwendet. Wie man das Zahngold aus gezogenen Zähnen mit Citronensäure herauslösen kann, erklären wir hier.
Eine große Rolle spielt Gold in der Elektronik und EDV-Technik. Die Kontakte von Speicherkarten sind oft vergoldet. Auch andere Teile, die beim Computer Verwendung finden, enthalten Goldbeschichtungen. Auf Scheckkarten entdeckt man den goldenen Chip.

Bild 4: Gold in der EDV
(Fotos: Blume)
Man kann auch Kunststofffolien mit Gold beschichten, indem man sie bedampft. Anhand dieser Folien
kann man das Phänomen studieren, dass dünnste Goldschichten in der Durchsicht blaugrün erscheinen. Das liegt daran, dass
feinverteiltes Gold rot ist. Man kennt das vom Rubinglas, dessen farbgebende Komponente kolloidal verteiltes
Gold ist. Die Komplementärfarbe zu Rot ist bekanntlich Blaugrün.

Bild 5: Goldfolie. Aufsicht und Durchsicht gegen Licht
(Fotos: Blume)
Rüdiger Blume
Literatur
[1] A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. Walter de Gruyter. Berlin, New York (neueste Auflage).
[2] L. F. Trueb: Die chemischen Elemente. S. Hirzel Verlag. Stuttgart 1996.
[3] G. Jander, E. Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. S. Hirzel Verlag. Stuttgart 1962.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 28. März 2014, Dagmar Wiechoczek

