Prof. Blumes Tipp des Monats Mai 2010 (Tipp-Nr. 155)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Chemie mit Curry

Bild 1: Currywurst (Foto: Blume)
Was wäre die geliebte Bratwurst ohne das gelbe, scharfe Pulver, das man darüber streut und womit man
die schlichte Bratwurst in den Adelsstand einer Currywurst erhebt!

Bild 2: Curry-Pulver aus Mauritius
(Mitbringsel von Daggi; Foto: Blume)
Der Grundstoff von Curry ist das fein gemahlene gelbe Rhizom (das sind unterirdische Sprossachsen,
die als Speicherorgan dienen) des Curcuma-Strauchs, der mit Ingwer (Zingiber officinale)
verwandt ist: Curcuma longa. Das Gewürz heißt (wie sollte es auch anders sein) Curcuma, sein gelber Farbstoff
ist das Curcumin. Beachten Sie, wenn Sie recherchieren: Die Namen werden oft mit K geschrieben:
Kurkuma und Kurkumin.
Mit 30 Masse% ist das gelbe Curcumin der Hauptbestandteil von europäischem Curry. Es schmeckt ingwerartig und zugleich mehr oder weniger scharf. Im Curry sind aber noch die Curcuma-Terpene (wie das Tumeron und das typische Ingweraroma Zingiberen) enthalten, dazu auch noch Koriander, Paprikapulver, Pfeffer, Chilies und vieles andere mehr. Dabei hat jedes Land sein eigenes Rezept. Auf den Zutatenlisten steht manchmal auch Cumin. Das hat nichts mit Curcumin zu tun, sondern ist ein Gewürz aus gemahlenem Kreuzkümmel.
Als billiger Ersatzstoff für den teuren gelben Krokusfarbstoff Safran (Crocin bzw. Crocetin) ist Curcumin lebensmittelrechtlich unter E 100 zugelassen. So färbt man mit ihm auch Senf und Käse.
Er dient aber auch als Farbstoff für Leder, Wolle und Seide. Es handelt sich um einen direkt aufziehenden Farbstoff, der aber leider nicht lichtecht ist. Beim Bestrahlen mit einer UV-Lampe (Wellenlänge 366 nm) zeigt der wässrige Curryauszug besonders im Neutralen und Sauren eine gelbe Fluoreszenz. Das hatten wir auch schon beim Farbstoff Berberin gesehen. Man erkennt die Fluoreszenz auch im Folgenden Bild 3; im Gegenlicht scheint die Lösung 2 diffus zu schimmern.
Man sagt dem Curcumin Säure/Base-Indikatoreigenschaften nach
Das wollen wir untersuchen. Wir merken dabei, dass Currypulver in Wasser schlecht löslich ist. Versuchen wir es
mit einem alkoholischen Auszug.
|
Versuch 1: Currypulver als Säure/Base-Indikator
Die braune Lösung in Glas 3 säuern wir zum Schluss noch an.
|

Bild 3: Curry-Auszug als Säure/Base-Indikator
1 Alkoholische Lösung, 2 wässrig sauer bis neutral, 3
wässrig alkalisch
(Foto: Blume)
Der im Curry enthaltene Farbstoff Curcumin ist somit ein Säure/Base-Indikator zum Nachweis
von Laugen. Im Sauren und Neutralen ist er hellgelb, im Alkalischen ab pH 8-9 rotbraun. Im stark Alkalischen
färbt sich die Lösung sogar orange. Damit gleicht er in gewisser Weise dem Indikator Phenolphthalein,
der bei pH 9 umschlägt.
Es gibt sogar Reagenzpapier zu kaufen: Curcuma-Papier (oder auch Kurkuma-Papier geschrieben). Das kann man sich auch selbst herstellen. Dazu tränkt man Filterpapier mit einem alkoholischen Auszug aus Currypulver. Das gelbe Papier wird beim Kontakt mit Alkalien braun. Die Farben werden deutlicher, wenn man das Papier trocknet.
|
Versuch 2: Curcuma-Papier aus Currypulver
Ergebnis: Im Sauren verändert sich die gelbe Farbe des Streifens nicht. Im Alkalischen beobachten wir eine Farbvertiefung in Richtung auf Orangebraun. |

Bild 4: Aus Curry-Pulver selbst hergestelltes Curcuma-Papier
1 Neutral, 2 mit Borsäure/HCl, 3 mit Borsäure/NaOH,
4 mit NaOH
(Foto: Blume)
Curcumin als Borsäure-Indikator
Curcumin ist nicht nur ein Indikator zum Nachweis von Laugen, sondern dient darüber hinaus auch als
Nachweis von Borsäure und Boraten. Das geht aber nur mit Curcuma-Papier, weil man es zwischendurch
trocknen muss.
|
Versuch 3: Borsäure-Indikator
|
Hier sind die Ergebnisse mit einem professionell hergestellten Curcuma-Papier (z. B. von Macherey und Nagel®).

Bild 5: Professionelles Curcuma-Papier
1 Neutral, 2 mit Borsäure/HCl, 3 mit Borsäure/NaOH, 4
mit NaOH
(Foto: Blume)
Unser Papier in Bild 4 ist zwar nicht so perfekt, aber dafür selbst gemacht…
Warum ist der Borsäure-Nachweis so wichtig?
Früher diente Borsäure (E 284) zur Konservierung vor allem von Meeresfrüchten. Borsäure wirkt besonders gegen Mikroorganismen,
indem sie den Phosphat-Metabolismus stört; auch beim von Pyridoxalphosphat abhängigen Ab- und Umbau von Aminosäuren
soll sie hemmend wirken, da sie mit dem Pyridoxal (Vitamin B6) Komplexe bildet. (Zur Komplexbildung von
Borsäure siehe weiter unten.)
Zuviel Borsäure kann zum Beispiel die Funktion von biologischen Reinigungsstufen in Kläranlagen behindern.
Heute ist diese Substanz verboten. Denn man hat festgestellt, dass sie sich im Fettgewebe und damit auch im Zentralnervensystem des Menschen anreichert. Über gesundheitliche Schäden wird durchaus diskutiert.
Das ist auch besonders wichtig, weil viele Waschmittel Borsäure-Derivate enthalten. Das sind die als Bleichmittel verwendeten Perborate. Sie werden aber zunehmend durch Natriumpercarbonate ersetzt.
Curcuma-Papier dient deshalb bei der Wassergüteprüfung als Schnelltest zur Borsäure-Bestimmung. Die Nachweisgrenze liegt bei diesem Papier bei 20 mg Bor/l Wasser.
Woher rühren die Farbänderungen?
Das folgende Bild zeigt die Struktur des Curcumins. Bemerkenswert ist nicht nur der symmetrische Aufbau
des Moleküls, sondern auch, dass es zwei Strukturen gibt. Denn die Verbindung unterliegt einem chemischen Gleichgewicht,
der Keto-Enol-Tautomerie; deswegen gehört Curcumin zur Gruppe der Hydroxyketon-Farbstoffe.

Bild 6
Damit können wir die Säure/Base-Indikatoreigenschaften erklären: Wir haben hier ein
Beispiel für eine CH-acide Verbindung. Im Alkalischen wird nicht nur das (Di-)Phenolat gebildet, sondern auch ein
Proton aus dem Keto-Enol-System abgespalten. Das dabei freigesetzte Elektronenpaar verstärkt die Absorption des
sichtbaren Lichts; daher beobachten wir im Alkalischen die Farbänderung in Richtung auf Orangebraun.
Zu den Farbänderungen durch die Borsäure bzw. das Borat: Die Ketohydroxy-Gruppierung ist Ligand eines Komplexes mit Bor als Zentralatom. In diesem Zusammenhang sei an den Hydroxyketon-Farbstoff Alizarin erinnert, der mit dem ebenfalls in der 3. Hauptgruppe des PSE (Borgruppe) befindlichen Aluminium Komplexe bildet. Wie das Aluminiumatom hat auch das Boratom eine Elektronenlücke, kann also als Lewissäure fungieren. Die maximale Ligandenzahl des Bors beträgt 4, wie z. B. im Komplex [BF4]-. Der mesomere Zustand des zentralen Sechsringsystems wirkt sich zusätzlich farbvertiefend aus.
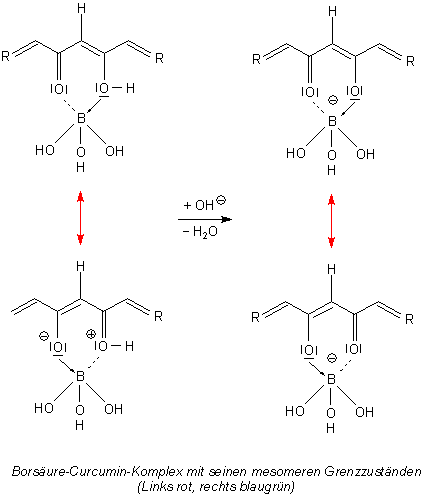
Bild 7
Warum die Bratwurst (auch ohne Curry) so gut schmeckt, liegt an den Maillard-Produkten. Darüber berichten wir im Tipp des Monats Nr. 25.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 02. Februar 2015, Dagmar Wiechoczek